Hvorfor korroderer guld og platin ikke i fugtig luft?
1. Ædle metaller:
* Høj elektronegativitet: Guld og platin har høj elektronegativitet, hvilket betyder, at de har et stærkt greb på deres elektroner og modstår at miste dem til at danne kemiske bindinger med andre elementer. Dette gør dem meget stabile og ureaktive.
* inertness: Disse metaller betragtes som "ædle metaller" på grund af deres inertitet. De er meget modstandsdygtige over for oxidation, som er processen med at reagere med ilt for at danne oxider. Oxider er ofte ansvarlige for korrosion i andre metaller.
2. Manglende reaktivitet:
* stærke metalliske obligationer: Guld og platin har stærke metalliske bindinger inden for deres strukturer. Disse obligationer er vanskelige at bryde, hvilket gør dem modstandsdygtige over for kemiske angreb fra miljøet.
* lav reaktivitet med ilt: Mens de kan reagere med ilt ved meget høje temperaturer, reagerer de ikke let med ilt ved normale temperaturer og tryk. Derfor danner de ikke oxider og korroderer i fugtig luft.
3. Overfladebeskyttelse:
* beskyttende oxidlag: Selvom det ikke er så fremtrædende som i nogle andre metaller, kan guld og platin danne tynde, meget stabile oxidlag på deres overflader. Disse lag fungerer som en barriere og beskytter metallet mod yderligere korrosion.
4. Undtagelse:
* Aqua Regia: Selvom det generelt er resistente over for korrosion, kan guld opløses i en blanding af koncentreret salpetersyre og saltsyre, kendt som Aqua Regia. Dette skyldes, at blandingen skaber en kompleks ion, der tillader guld at opløses.
Konklusion:
Kombinationen af deres høje elektronegativitet, inertitet, stærke metalliske bindinger og beskyttelsesoxidlag gør guld og platin meget modstandsdygtig over for korrosion i fugtig luft. Derfor bruges de ofte til smykker, mønter og andre applikationer, hvor holdbarheden er afgørende.
Sidste artikelHvilke faseændringer involverer frigivelse af varme?
Næste artikelEr fordampning og kondens begge typer fordampning?
 Varme artikler
Varme artikler
-
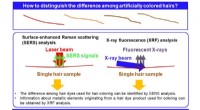 Inden for en hårsbredde – retsmedicinsk identifikation af enkeltfarvet hårstrå nu muligtEn oversigt over de analytiske teknikker, der er brugt i denne undersøgelse, som tilsammen gør det muligt at skelne mellem to enkeltstrå farvet hår. Kredit:Shinsuke Kunimura fra Tokyo University of Sc
Inden for en hårsbredde – retsmedicinsk identifikation af enkeltfarvet hårstrå nu muligtEn oversigt over de analytiske teknikker, der er brugt i denne undersøgelse, som tilsammen gør det muligt at skelne mellem to enkeltstrå farvet hår. Kredit:Shinsuke Kunimura fra Tokyo University of Sc -
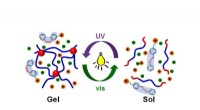 Fotoreversibel molekylær switch ændrer den fysiske egenskab af termoresponsiv polymerSkematisk illustration af sol-gelovergang udløst af fotoisomerisering af azobenezen-holdig ionisk flydende molekylær switch. Kredit:Yokohama National University Forskere har udviklet en ny strateg
Fotoreversibel molekylær switch ændrer den fysiske egenskab af termoresponsiv polymerSkematisk illustration af sol-gelovergang udløst af fotoisomerisering af azobenezen-holdig ionisk flydende molekylær switch. Kredit:Yokohama National University Forskere har udviklet en ny strateg -
 Team afslører overraskende detaljer om afgørende energiproducerende enzymNebraskas Oleh Khalimonchuk har hjulpet med at opklare længe skjulte detaljer om dannelsen af cytochrom c-oxidase (venstre), et enzym, der er afgørende for at producere den energi, der driver alle m
Team afslører overraskende detaljer om afgørende energiproducerende enzymNebraskas Oleh Khalimonchuk har hjulpet med at opklare længe skjulte detaljer om dannelsen af cytochrom c-oxidase (venstre), et enzym, der er afgørende for at producere den energi, der driver alle m -
 Hvad er peberspray?Kredit:The American Chemical Society Uanset om det er at gå ned ad en mørk gade om natten eller kæmpe mod grizzlybjørne på stien, peberspray er et effektivt redskab til at afværge en angriber og k
Hvad er peberspray?Kredit:The American Chemical Society Uanset om det er at gå ned ad en mørk gade om natten eller kæmpe mod grizzlybjørne på stien, peberspray er et effektivt redskab til at afværge en angriber og k
- Kan jeg blande disse kemikalier? Der er en app til det!
- Barrierer for afstemning betyder noget, men amerikanerne overser deres indflydelse, viser undersøge…
- Forskere forvandler øl til brændstof
- En 38 grader nordlig breddegrad er hvilket kontinent?
- Hvilken varme kan en bunsenbrænder nå?
- Hvad er det maksimale antal spdf i kemi?


