En forbindelse dannet på 0,059 mol hydrogenand 0,94 oxyEgn har en molekylær masse 34,0 Hvad er formlen denne forbindelse?
1. Find molforholdet mellem brint og ilt:
* Opdel molen for hvert element med det mindste antal mol:
* Hydrogen:0,059 mol / 0,059 mol =1
* Oxygen:0,94 mol / 0,059 mol ≈ 16
* Dette giver os et foreløbigt molforhold på H₁O₁₆, men det er usandsynligt, at det er den faktiske formel.
2. Beregn den empiriske formelmasse:
* Den empiriske formelmasse er massen af det enkleste forhold mellem hele nummeret mellem elementer i forbindelsen.
* H₁O₁₆:(1 x 1,01 g/mol) + (16 x 16,00 g/mol) ≈ 257,01 g/mol
3. Bestem den molekylære formel:
* Opdel den molekylære masse af forbindelsen med den empiriske formelmasse:
* 34,0 g/mol/257,01 g/mol ≈ 0,13
* Dette betyder, at den molekylære formel er cirka 0,13 gange den empiriske formel. Da vi har brug for hele tal, kan vi multiplicere den empiriske formel med 8 for at få et helt tal:
* 0,13 x 8 ≈ 1
* Den molekylære formel er derefter:(H₁O₁₆) ₈ = H₈O₁₂₈
Vigtig note: Den beregnede molekylære formel H₈O₁₂₈ er yderst usandsynlig at være en stabil forbindelse. Det er vigtigt at erkende, at de givne oplysninger kan være forkerte, eller at forbindelsens dannelse er meget usandsynlig.
Fortæl mig, hvis du har andre kemi -spørgsmål!
 Varme artikler
Varme artikler
-
 Fremstilling af polymerstrukturer hurtigere - to processer i en maskineMålet er at bruge kombimaskinen til at producere forgrenede mikrorør samt komplette mikrofluidiske systemer. Kredit:Fraunhofer ILT, Aachen, Tyskland Enten hurtigt eller præcist - begge dele kan ik
Fremstilling af polymerstrukturer hurtigere - to processer i en maskineMålet er at bruge kombimaskinen til at producere forgrenede mikrorør samt komplette mikrofluidiske systemer. Kredit:Fraunhofer ILT, Aachen, Tyskland Enten hurtigt eller præcist - begge dele kan ik -
 Nyt elektrisk aktiveret materiale kan forbedre braillelæsereKredit:CC0 Public Domain Opdaterbare brailleskærme oversætter information fra computerskærme til hævede tegn, ofte langs bunden af et tastatur. Men denne teknologi kan koste tusindvis af dollars
Nyt elektrisk aktiveret materiale kan forbedre braillelæsereKredit:CC0 Public Domain Opdaterbare brailleskærme oversætter information fra computerskærme til hævede tegn, ofte langs bunden af et tastatur. Men denne teknologi kan koste tusindvis af dollars -
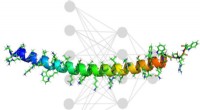 Maskinlæring opdager nye sekvenser for at booste medicinleveringMIT-forskere kombinerede eksperimentel kemi med kunstig intelligens for at opdage ikke-giftige, højaktive peptider, der kan bindes til phosphorodiamidat morpholino-oligomerer (PMO) for at hjælpe med l
Maskinlæring opdager nye sekvenser for at booste medicinleveringMIT-forskere kombinerede eksperimentel kemi med kunstig intelligens for at opdage ikke-giftige, højaktive peptider, der kan bindes til phosphorodiamidat morpholino-oligomerer (PMO) for at hjælpe med l -
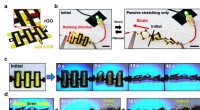 3D form rekonfiguration af strækbar elektronik(a) Skematisk illustration af kirigami-inspireret rGO-mønstret azo-LCN (kirigami azo-LCN/rGO). Formdeformation af kirigami azo-LCN/rGO under (b) passiv type mekanisk strækning, (c) aktiv type UV-stimu
3D form rekonfiguration af strækbar elektronik(a) Skematisk illustration af kirigami-inspireret rGO-mønstret azo-LCN (kirigami azo-LCN/rGO). Formdeformation af kirigami azo-LCN/rGO under (b) passiv type mekanisk strækning, (c) aktiv type UV-stimu
- Forskere identificerer patogenet, der forårsager søpindsvinsmassedødelighed i Det Røde Hav
- Sådan fungerer geodætiske kupler
- Videnskabseksperimenter på pH-niveauer
- Hvor glad og sund er din kanin?
- Hvordan er kinetisk energi og momentum ens?
- Forskere udvikler nanopartikelfilm til datalagring med høj tæthed


