Hvorfor ændrer gasser sig til væsker, når de mister nok varme?
1. Molekylær bevægelse og energi
* Gasser: Gasmolekyler er i konstant, hurtig og tilfældig bevægelse. De har en masse kinetisk energi (bevægelsesenergi) og er langt fra hinanden.
* væsker: Flydende molekyler bevæger sig langsommere og er tættere sammen end gasmolekyler. De har mindre kinetisk energi.
2. Rollen som varme
* varme er energi: Varme er en form for energi, der øger molekylernes kinetiske energi. Når en gas absorberer varme, bevæger dens molekyler sig hurtigere og spreder sig længere fra hinanden.
* afkøling: Når en gas mister varmen, bremser dens molekyler og bevæger sig tættere sammen.
3. Intermolekylære kræfter
* svage kræfter i gasser: I gasser er intermolekylære kræfter (attraktionerne mellem molekyler) meget svage, fordi molekylerne er langt fra hinanden.
* stærkere kræfter i væsker: Når gasmolekyler bremser og kommer nærmere, bliver intermolekylære kræfter stærkere. Disse kræfter holder molekylerne sammen i en mere organiseret tilstand og danner en væske.
4. Kondens:faseændringen
* kondens: Processen med en gas, der bliver til en væske, kaldes kondens. Det opstår, når gassen afkøles til det punkt, hvor de intermolekylære kræfter bliver stærke nok til at overvinde molekylernes kinetiske energi.
Kortfattet:
Når en gas mister nok varme, bremser dens molekyler. Den reducerede kinetiske energi giver intermolekylære kræfter mulighed for at gribe fat, trække molekylerne tættere sammen og resultere i en mere ordnet flydende tilstand. Denne ændring i tilstand kaldes kondensation.
Sidste artikelHvad er kemikalierformel for fennikel?
Næste artikelHvordan får du opløste stoffer ud af vandet?
 Varme artikler
Varme artikler
-
 Organiske solceller, der holder 10 år i rummetKredit:Skoltech 6, 000 Gy, vækker håb om deres stabile drift i kredsløb nær jorden over 10 år eller endnu længere. Resultaterne af undersøgelsen blev offentliggjort i ACS anvendte materialer og g
Organiske solceller, der holder 10 år i rummetKredit:Skoltech 6, 000 Gy, vækker håb om deres stabile drift i kredsløb nær jorden over 10 år eller endnu længere. Resultaterne af undersøgelsen blev offentliggjort i ACS anvendte materialer og g -
 En kunstig tunge af guld til at smage ahornsirupKredit:University of Montreal Det siges, at ahornsirup er Quebecs flydende guld. Nu har forskere ved Université de Montréal fundet en måde at bruge ægte guld – i form af nanopartikler – for hurtig
En kunstig tunge af guld til at smage ahornsirupKredit:University of Montreal Det siges, at ahornsirup er Quebecs flydende guld. Nu har forskere ved Université de Montréal fundet en måde at bruge ægte guld – i form af nanopartikler – for hurtig -
 De fem mest mærkelige giftstoffer, der kan dræbe digDer er nogle skøre giftstoffer i vores verden, og de findes ofte i ting, du mindst ville forvente. I denne uges afsnit af Reaktioner, vi nedbryder vores top fem mærkeligste giftstoffer.
De fem mest mærkelige giftstoffer, der kan dræbe digDer er nogle skøre giftstoffer i vores verden, og de findes ofte i ting, du mindst ville forvente. I denne uges afsnit af Reaktioner, vi nedbryder vores top fem mærkeligste giftstoffer. -
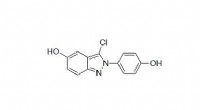 Kemisk forbindelse producerer gavnlig inflammation, remyelinisering, der kan hjælpe med at behandle…Kemisk struktur af indazolchlorid. Kredit:J. Katzenellenbogen, UIUC. Lægemidler til rådighed til behandling af multipel sklerose, en førende årsag til neurologisk handicap, der påvirker omkring 2,
Kemisk forbindelse producerer gavnlig inflammation, remyelinisering, der kan hjælpe med at behandle…Kemisk struktur af indazolchlorid. Kredit:J. Katzenellenbogen, UIUC. Lægemidler til rådighed til behandling af multipel sklerose, en førende årsag til neurologisk handicap, der påvirker omkring 2,


