Hvorfor har din idé om, hvordan atomerne ser ud, ændret så mange gange?
Jeg kan dog fortælle dig, hvordan vores forståelse af atomer har ændret sig gennem historien:
* Tidlige modeller: I de tidlige dage blev atomer betragtet som så solide, udelelige sfærer.
* Daltons model: I det 19. århundrede foreslog John Dalton, at atomer af et givet element er identiske, og at atomer kombineres i forhold mellem hele antal for at danne forbindelser.
* Thomsons model: J.J. Thomson opdagede elektroner og foreslog modellen "blomme budding", hvor elektroner var indlejret i en positivt ladet sfære.
* Rutherfords model: Ernest Rutherfords guldfolieeksperiment førte til den nukleare model, hvor en lille, positivt ladet kerne er omgivet af kredsende elektroner.
* Bohrs model: Niels Bohr raffinerede Rutherfords model ved at foreslå, at elektroner optager specifikke energiniveauer, og at de kan hoppe mellem niveauer ved at absorbere eller udsende lys.
* kvantemekanisk model: Denne model, der er udviklet i det 20. århundrede, beskriver elektronernes opførsel med hensyn til sandsynlighedsfordelinger snarere end faste kredsløb. Det er den mest nøjagtige model, vi har i dag.
Så grunden til, at vores forståelse af atomer har ændret sig så meget, skyldes nye opdagelser og fremskridt inden for videnskabelig teknologi . Hver ny opdagelse og eksperiment har ført til en mere raffineret og nøjagtig forståelse af atomets struktur og opførsel. Vi fortsætter med at lære mere om atomer, og vores forståelse kan fortsat udvikle sig i fremtiden.
Sidste artikelHvad er CFC's rolle i ozonødelæggelse?
Næste artikelHvad står jeg for i en sikring mærket T2AL 250V?
 Varme artikler
Varme artikler
-
 Lysstyret strømtransport med ladede atomer demonstreret for første gangEn tidligere ukendt fotoeffekt:i nogle materialer, såsom i perovskit methylammonium blyiodid (MAPI), ioner bidrager meget stærkt til lysinduceret ledningsevne. Som sædvanligt i solceller, lyset frigiv
Lysstyret strømtransport med ladede atomer demonstreret for første gangEn tidligere ukendt fotoeffekt:i nogle materialer, såsom i perovskit methylammonium blyiodid (MAPI), ioner bidrager meget stærkt til lysinduceret ledningsevne. Som sædvanligt i solceller, lyset frigiv -
 Glaslignende træ isolerer varme, er hård, blokerer UV og har trækornet mønsterIngeniører ved University of Maryland designede et gennemsigtigt loft lavet af træ, der fremhæver det naturlige trækornmønster. Kredit:A.James Clark School of Engineering, University of Maryland B
Glaslignende træ isolerer varme, er hård, blokerer UV og har trækornet mønsterIngeniører ved University of Maryland designede et gennemsigtigt loft lavet af træ, der fremhæver det naturlige trækornmønster. Kredit:A.James Clark School of Engineering, University of Maryland B -
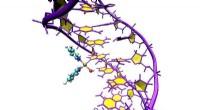 Hvordan interagerer metaller med DNA?Computersimuleringer viser den præcise placering af Pt103 i DNA. Kredit:Juan J. Nogueira, Universitetet i Wien I et par årtier, metalholdige lægemidler er med succes blevet brugt til at bekæmpe vi
Hvordan interagerer metaller med DNA?Computersimuleringer viser den præcise placering af Pt103 i DNA. Kredit:Juan J. Nogueira, Universitetet i Wien I et par årtier, metalholdige lægemidler er med succes blevet brugt til at bekæmpe vi -
 At afsløre træets nanostruktur kan hjælpe med at hæve højdegrænserne for træskyskrabereKredit:CC0 Public Domain Der er stigende interesse rundt om i verden for at bruge træ som lighter, mere bæredygtigt byggealternativ til stål og beton. Mens træ har været brugt i bygninger i årtusi
At afsløre træets nanostruktur kan hjælpe med at hæve højdegrænserne for træskyskrabereKredit:CC0 Public Domain Der er stigende interesse rundt om i verden for at bruge træ som lighter, mere bæredygtigt byggealternativ til stål og beton. Mens træ har været brugt i bygninger i årtusi
- Hvad er standardtesten for CO2?
- Kommer til en laboratoriebænk i nærheden af dig:Femtosekund røntgenspektroskopi
- Hvad er Gaussisk Distribution?
- Hvorfor er nanopartikler af legeret metal bedre end monometalliske til CNT-vækst?
- Kosmisk beton udviklet af rumstøv og astronautblod
- Fisk krymper, når havets temperatur stiger


