Hvad kaldes en klosterobligation, hvor elektroner deles lige?
Her er hvorfor:
* kovalent binding: En obligation dannet ved deling af elektronpar mellem atomer.
* ikke -polær: Beskriver et molekyle eller binding, hvor der ikke er nogen adskillelse af ladning (ingen positive eller negative poler).
I en ikke -polær kovalent binding deles elektronerne lige, fordi de involverede atomer har lignende elektronegativiteter. Elektronegativitet er et atoms evne til at tiltrække elektroner mod sig selv i en kemisk binding. Når atomer har lignende elektronegativiteter, trækker de på de delte elektroner med lige kraft, hvilket resulterer i en jævn fordeling af elektrondensitet.
Eksempler på ikke -polære kovalente obligationer:
* h-h (brintgas)
* cl-cl (klorgas)
* o =o (iltgas)
* c-h (obligationer i metan, CH4)
Sidste artikelHvordan beskriver du partikler i en løsning?
Næste artikelHvad er ligevægtskonstanten for reaktion SO2?
 Varme artikler
Varme artikler
-
 Den kemiske udvikling af DNA og RNA på den tidlige JordDe grundlæggende bestanddele af de tidligste RNA-molekyler kan være dannet i et geotermisk miljø, sådan set her i Yellowstone National Park i Wyoming. Foto:picture alliance / Mint Images RNA var s
Den kemiske udvikling af DNA og RNA på den tidlige JordDe grundlæggende bestanddele af de tidligste RNA-molekyler kan være dannet i et geotermisk miljø, sådan set her i Yellowstone National Park i Wyoming. Foto:picture alliance / Mint Images RNA var s -
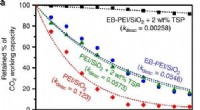 Forskere producerer 50x mere stabilt adsorbentKuldioxid arbejdskapacitet mod oxidativ ældningstid. Udførelsen af den foreslåede metode (sort) forringes meget langsommere (~ 50x) end eksisterende metoder. Det nye adsorbent er således vist at vær
Forskere producerer 50x mere stabilt adsorbentKuldioxid arbejdskapacitet mod oxidativ ældningstid. Udførelsen af den foreslåede metode (sort) forringes meget langsommere (~ 50x) end eksisterende metoder. Det nye adsorbent er således vist at vær -
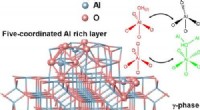 Karten af fem-koordineret aluminium på γ-Al2O3 overfladeGrafisk abstrakt. Kredit:ACS Central Science (2022). DOI:10.1021/acscentsci.1c01497 y-Al2 O3 , en vigtig katalysator og katalysatorbærer, er meget udbredt i forskellige industrielle anvendelser. De
Karten af fem-koordineret aluminium på γ-Al2O3 overfladeGrafisk abstrakt. Kredit:ACS Central Science (2022). DOI:10.1021/acscentsci.1c01497 y-Al2 O3 , en vigtig katalysator og katalysatorbærer, er meget udbredt i forskellige industrielle anvendelser. De -
 En milepæl inden for ultrahurtig gelfremstilling fra ukonventionelle selvhelbredende ædelmetalgele…Ultrahurtig gelfremstilling. Kredit:Ran DU et al. Sage 2020. Elektrokatalyse er i vid udstrækning involveret i mange vigtige energirelaterede processer, såsom oxygenreduktionsreaktionen (ORR) for
En milepæl inden for ultrahurtig gelfremstilling fra ukonventionelle selvhelbredende ædelmetalgele…Ultrahurtig gelfremstilling. Kredit:Ran DU et al. Sage 2020. Elektrokatalyse er i vid udstrækning involveret i mange vigtige energirelaterede processer, såsom oxygenreduktionsreaktionen (ORR) for
- Seismometeraflæsninger kan give en tidlig advarsel om debrisflow
- Hvor mange fødder og inches er der i 508 cm?
- Spiser mennesker nogen grønne planter?
- Sorte mandlige unge er mere bange, når de besøger hvidere kvarterer
- Her er hvordan Curiositys himmelkran ændrede måden, NASA udforsker Mars på
- Hvad gør et kemikalie? Adressering af misforståelser om kemi


