Hvorfor er bestemt volumen en fysisk egenskab i flydende tilstand?
* Stærke intermolekylære kræfter: Flydende molekyler er tættere sammen end gasmolekyler, og de intermolekylære kræfter (som hydrogenbinding, dipol-dipol og London-spredningskræfter) er stærke nok til at holde molekylerne i relativt faste positioner.
* Begrænset bevægelse: Mens flydende molekyler kan bevæge sig rundt og glide forbi hinanden, er deres bevægelse begrænset sammenlignet med gasser. Dette betyder, at de ikke udvides til at fylde hele beholderen, som gasser gør.
* Fast form: Formen på en væske er ikke fast og vil tage formen på dens beholder. Volumenet forbliver imidlertid konstant, fordi de intermolekylære kræfter holder molekylerne sammen, hvilket forhindrer dem i at udvide sig markant.
I modsætning:
* Gasser Har svage intermolekylære kræfter, og deres molekyler er langt fra hinanden, så de kan udvide til at fylde enhver beholder. De har ikke et bestemt volumen.
* faste stoffer Har ekstremt stærke intermolekylære kræfter, der holder molekylerne i en stiv, fast struktur. De har også et bestemt volumen, men i modsætning til væsker har de en bestemt form.
Derfor bidrager de stærke intermolekylære kræfter og begrænset bevægelse af flydende molekyler til deres konkrete volumen.
 Varme artikler
Varme artikler
-
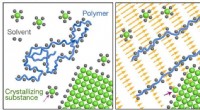 Forbedring af krystalvækst ved hjælp af polyelektrolytopløsninger og forskydningsflowFigur 1. Skema af den formodede mekanisme:polymeren (blå) og den krystalliserende substans (grøn) konkurrerer om delt opløsningsmiddel (grå). Når forskydningsflow er fraværende (venstre), mængden af
Forbedring af krystalvækst ved hjælp af polyelektrolytopløsninger og forskydningsflowFigur 1. Skema af den formodede mekanisme:polymeren (blå) og den krystalliserende substans (grøn) konkurrerer om delt opløsningsmiddel (grå). Når forskydningsflow er fraværende (venstre), mængden af -
 Innovationspionerer scorer verdens først for bæredygtigt byggeri med grafenbetonTeam fra University of Manchester og Nationwide Engineering om verdens første konstruerede grafenbeton i kommercielle omgivelser, kun et par kilometer øst for det gamle monument i Stonehenge, det nye
Innovationspionerer scorer verdens først for bæredygtigt byggeri med grafenbetonTeam fra University of Manchester og Nationwide Engineering om verdens første konstruerede grafenbeton i kommercielle omgivelser, kun et par kilometer øst for det gamle monument i Stonehenge, det nye -
 Kulfibre fra grønne prækursorer og optimerede processerKredit:fabiodevilla, Shutterstock Smarte materialer svarer på sammensatte komponenter for at tilbyde række af ønskede egenskaber, alligevel har de nuværende fremstillingsprocesser på nogle måder i
Kulfibre fra grønne prækursorer og optimerede processerKredit:fabiodevilla, Shutterstock Smarte materialer svarer på sammensatte komponenter for at tilbyde række af ønskede egenskaber, alligevel har de nuværende fremstillingsprocesser på nogle måder i -
 Forskere foreslår en ny metode til storskala produktion af termisk stabile enkeltatomkatalysatorerKredit:CC0 Public Domain En forskergruppe ledet af prof. Qiao Botao fra Dalian Institute of Chemical Physics (DICP) fra det kinesiske videnskabsakademi har foreslået en ny metode til storskala pro
Forskere foreslår en ny metode til storskala produktion af termisk stabile enkeltatomkatalysatorerKredit:CC0 Public Domain En forskergruppe ledet af prof. Qiao Botao fra Dalian Institute of Chemical Physics (DICP) fra det kinesiske videnskabsakademi har foreslået en ny metode til storskala pro
- Kunne renset spildevand være et værktøj mod havniveaustigning?
- Forskere undersøger transport af nanopartikler i den menneskelige krop
- Ville beryllium have egenskaber, der ligner magnesium?
- Energiministeriet siger, at det vil fjerne plutonium fra Nevada
- Hvad er breddegrad og længdegrad i Middelhavet?
- Ondsindet indhold udnytter veje mellem platforme for at trives online, undergrave mådehold


