Hvad er grunden til relativt lav isdensitet?
Her er forklaringen:
* vandmolekyler er polære: Oxygenatomet i et vandmolekyle har en lidt negativ ladning, mens brintatomerne har lidt positive ladninger. Denne polaritet tillader vandmolekyler at danne hydrogenbindinger med hinanden.
* hydrogenbindinger i flydende vand: I flydende vand dannes og bryder disse bindinger konstant, hvilket gør det muligt for molekylerne at bevæge sig frit og pakke relativt tæt sammen.
* hydrogenbindinger i is: Når vand fryser, bliver brintbindingerne mere stabile og holder molekylerne i en fast, krystallinsk struktur. Denne struktur er kendetegnet ved en åben, hexagonal gitter med store tomme rum mellem molekylerne.
* lavere densitet: På grund af disse store rum har is en lavere densitet end flydende vand. Dette er grunden til, at is flyder!
I resumé fører den åbne, krystallinske struktur af is, der er resultatet af de stabile brintbindinger mellem vandmolekyler, til dens lavere densitet sammenlignet med flydende vand.
Sidste artikelEr helium tæt eller mindre end vand?
Næste artikelHvad er en formel for natriumhydrogensulfid?
 Varme artikler
Varme artikler
-
 Forskere forbinder kvartsmikrobalancemålinger med internationalt målesystemModsatte sider af en kvartskrystalresonator. Kredit:Bæger via Wikipedia Forskere ved National Institute of Standards and Technology (NIST) har fundet en måde at forbinde målinger foretaget af en e
Forskere forbinder kvartsmikrobalancemålinger med internationalt målesystemModsatte sider af en kvartskrystalresonator. Kredit:Bæger via Wikipedia Forskere ved National Institute of Standards and Technology (NIST) har fundet en måde at forbinde målinger foretaget af en e -
 Video:Små formskiftende polymerer udviklet til potentielle medicinske anvendelserKredit:Unsplash/CC0 Public Domain Ingeniører hos Caltech har udviklet en proces til generering af tredimensionelle arkitekterede polymerer med varmeafhængige formhukommelses egenskaber:Det vil sig
Video:Små formskiftende polymerer udviklet til potentielle medicinske anvendelserKredit:Unsplash/CC0 Public Domain Ingeniører hos Caltech har udviklet en proces til generering af tredimensionelle arkitekterede polymerer med varmeafhængige formhukommelses egenskaber:Det vil sig -
 Små børster, der gør overflader glatte, fungerer muligvis ikke efter hensigten, undersøgelse fin…I rent vand, disse små molekylære børster står lige op og bevarer en glat overflade. Men tilføjelse af ioner med +2 og +3 ladninger får dem til at klumpe og miste deres glathed (ovenfor). Kredit:Yu et
Små børster, der gør overflader glatte, fungerer muligvis ikke efter hensigten, undersøgelse fin…I rent vand, disse små molekylære børster står lige op og bevarer en glat overflade. Men tilføjelse af ioner med +2 og +3 ladninger får dem til at klumpe og miste deres glathed (ovenfor). Kredit:Yu et -
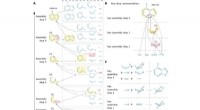 Samlingsteori kan betyde gode nyheder for lægemiddelopdagelseFig. 1. Repræsentationer af en samlingsvej, ved at tage adenin som eksempel. (A) En af adenins mange samlingsveje (det viser sig at være den korteste, ifølge vores MC-algoritme, forklaret senere). Sam
Samlingsteori kan betyde gode nyheder for lægemiddelopdagelseFig. 1. Repræsentationer af en samlingsvej, ved at tage adenin som eksempel. (A) En af adenins mange samlingsveje (det viser sig at være den korteste, ifølge vores MC-algoritme, forklaret senere). Sam
- Hvilken farve ser et grønt blad ud til at være i rødt lys?
- Amerikanske agenter i Memphis beslaglægger afsendt gammel egyptisk artefakt
- Nyt for tre typer ekstrem-energi rumpartikler:Teori viser ensartet oprindelse
- Grizzlies viser bemærkelsesværdig genkontrol før og under dvale
- Monsterbillede af Fornax Galaxy Cluster
- Mod hjernelignende computing:Ny memristor efterligner bedre synapser


