Hvordan klæber kobberatomerne i en krone sammen?
1. Elektroner i den yderste skal: Kobberatomer har elektroner i deres yderste skal, som er løst holdt.
2. Hav af elektroner: Når kobberatomer mødes for at danne et fast stof, bliver disse yderste elektroner delokaliseret. Dette betyder, at de ikke er bundet til noget bestemt atom, men snarere bevæge sig frit gennem hele strukturen. Dette skaber et "hav af elektroner".
3. attraktion: De positivt ladede kobberkerner tiltrækkes nu af dette negativt ladede hav af elektroner. Denne elektrostatiske attraktion er det, der holder kobberatomerne sammen i en stærk, metallisk binding.
nøglefunktioner ved metallisk binding:
* stærk: Metalliske bindinger er meget stærke, hvorfor metaller generelt er hårde og har høje smeltepunkter.
* Konduktivitet: De frit bevægende elektroner giver metaller mulighed for at udføre elektricitet og varme meget godt.
* formbarhed og duktilitet: Metallers evne til at være formet (formbarhed) eller trukket ind i ledninger (duktilitet) kommer fra fleksibiliteten af den metalliske binding. Elektronerne kan let justere deres positioner, når atomerne omarrangeres.
Kort sagt, havet af elektroner i en krone fungerer som lim, der holder kobberatomerne sammen i en stærk og stabil struktur.
Sidste artikelHvad indeholder interstitiel væske?
Næste artikelHvordan påvirker stigende koncentration af elektrolyt voltaisk celle?
 Varme artikler
Varme artikler
-
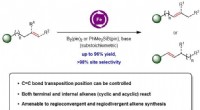 Manipulerer kædevandring i olefiner ved hjælp af jord-rigelige jernbaserede katalysatorerFigur 1:Skematisk viser migration af C =C -bindingen i alkener kan opnås ved hjælp af jernkatalyse med mindre end støkiometriske mængder af en base og borylreagens. Kredit: Journal of the American Che
Manipulerer kædevandring i olefiner ved hjælp af jord-rigelige jernbaserede katalysatorerFigur 1:Skematisk viser migration af C =C -bindingen i alkener kan opnås ved hjælp af jernkatalyse med mindre end støkiometriske mængder af en base og borylreagens. Kredit: Journal of the American Che -
 Maskinlæring muliggør optimalt design af anti-biofouling polymerbørstefilmKredit:Tokyo Tech Polymer børstefilm består af monomerkæder dyrket i umiddelbar nærhed på et substrat. Monomererne, der ligner børster på nanoskala, danner en yderst funktionel og alsidig belægning
Maskinlæring muliggør optimalt design af anti-biofouling polymerbørstefilmKredit:Tokyo Tech Polymer børstefilm består af monomerkæder dyrket i umiddelbar nærhed på et substrat. Monomererne, der ligner børster på nanoskala, danner en yderst funktionel og alsidig belægning -
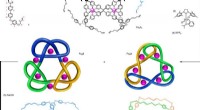 Forskere skaber det mest sammenfiltrede sammenlåste molekyle nogensindeDen 12 komponent (6 × ligand 1; 6 × Fe 2+ ) samling af det mellemliggende hexamere cirkulære helikat [Fe 6 1 6 ](PF 6 ) 12 og syntesen af +31#+31#+31 sammensatte knude 2 og 9 3 7 link
Forskere skaber det mest sammenfiltrede sammenlåste molekyle nogensindeDen 12 komponent (6 × ligand 1; 6 × Fe 2+ ) samling af det mellemliggende hexamere cirkulære helikat [Fe 6 1 6 ](PF 6 ) 12 og syntesen af +31#+31#+31 sammensatte knude 2 og 9 3 7 link -
 Aluminiumgenbrugsteknologi boostet af krystalliseringsforskningUnder påvirkning af magnetisk omrøring, spiralformede skruelignende krystaller dannes i smeltet legering. Kredit:Dr. Biao Cai En innovativ metode til genanvendelse af aluminium er blevet styrket a
Aluminiumgenbrugsteknologi boostet af krystalliseringsforskningUnder påvirkning af magnetisk omrøring, spiralformede skruelignende krystaller dannes i smeltet legering. Kredit:Dr. Biao Cai En innovativ metode til genanvendelse af aluminium er blevet styrket a
- Afslutning på et 50-årigt mysterium afslører videnskabsmænd, hvordan bakterier kan bevæge sig
- Ny forskning analyserer videospilspillerens engagement
- Nukleotider bruges til at sammensætte enheder på tre?
- Hvad er en truet art?
- Giv det videre:Råd om arbejdsliv fra Twitter-kurationsdirektør
- Små plankton driver processer i havet, der opfanger dobbelt så meget kulstof, som forskerne troede


