Forklar, hvorfor overgangsmetaller undertiden omtales som D-BLOK-elementer?
Her er en sammenbrud:
* Elektronkonfiguration: Elementer er organiseret på den periodiske tabel baseret på deres elektronkonfiguration, der beskriver, hvordan elektroner distribueres i forskellige energiniveauer og subles inden for et atom.
* orbitaler: Disse energiniveauer er yderligere opdelt i underniveauer, der hver svarer til en bestemt type orbital. Disse orbitaler er udpeget af bogstaver:S, P, D og F.
* d orbitaler: D orbitaler er et sæt af fem orbitaler med komplekse former. De begynder at udfylde efter S -orbitaler i det samme energiniveau.
* Overgangsmetaller: Overgangsmetaller er placeret i grupper 3-12 i den periodiske tabel. Deres karakteristiske træk er, at deres højeste energielektroner er i D -orbitaler. For eksempel har Iron (Fe) elektronkonfigurationen [AR] 3D 6 4S 2 . 3D -elektronerne er de differentierende elektroner, hvilket betyder, at de definerer dens position på den periodiske tabel.
Derfor kaldes overgangsmetaller D-blokelementer, fordi deres kendetegnende elektroner besætter d orbitaler.
 Varme artikler
Varme artikler
-
 Kemikere udvikler miljøvenlige nanokompositter fra frugt- og bærskalRUDN Chemists udviklede miljøvenlige nanokompositter fra frugt- og bærskræl til vandrensning, Kvalitativ analyse, og katalyse af organiske reaktioner Kredit:Natalia Deryugina En RUDN-kemiker synte
Kemikere udvikler miljøvenlige nanokompositter fra frugt- og bærskalRUDN Chemists udviklede miljøvenlige nanokompositter fra frugt- og bærskræl til vandrensning, Kvalitativ analyse, og katalyse af organiske reaktioner Kredit:Natalia Deryugina En RUDN-kemiker synte -
 Biokemikere afslører indsigt i ekstraordinær regenerativ evneIana Kim, første forfatter til den nye undersøgelse, i et laboratorium for forskningsgruppen Gene Regulation by Non-coding RNA ved University of Bayreuth. Kredit:Christian Wißler Planarer er flado
Biokemikere afslører indsigt i ekstraordinær regenerativ evneIana Kim, første forfatter til den nye undersøgelse, i et laboratorium for forskningsgruppen Gene Regulation by Non-coding RNA ved University of Bayreuth. Kredit:Christian Wißler Planarer er flado -
 Chokoladefingeraftryk kunne bekræfte påstande på etikettenKredit:CC0 Public Domain Smagen og aromaen af en fin chokolade kommer frem fra dens økologi, ud over dens behandling. Men kan du være sikker på, at den bar, du har købt, virkelig er fra det ekso
Chokoladefingeraftryk kunne bekræfte påstande på etikettenKredit:CC0 Public Domain Smagen og aromaen af en fin chokolade kommer frem fra dens økologi, ud over dens behandling. Men kan du være sikker på, at den bar, du har købt, virkelig er fra det ekso -
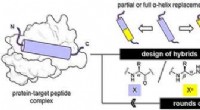 Oligourea foldamerer efterligner peptider alfa-helices og binder effektivt til lægemiddelmålKredit:Wiley Nogle nyttige lægemidler består af peptider, der virker på deres proteinmål. For at gøre dem mere effektive og stabile, forskere har fundet en måde at erstatte afgørende segmenter af
Oligourea foldamerer efterligner peptider alfa-helices og binder effektivt til lægemiddelmålKredit:Wiley Nogle nyttige lægemidler består af peptider, der virker på deres proteinmål. For at gøre dem mere effektive og stabile, forskere har fundet en måde at erstatte afgørende segmenter af
- Når gasformige molekyler komprimeres, har de en tendens til?
- Nile T-18 testet i et forsøg på at frigøre droneteknologi til aldrende landmænd i Japan
- Ny flydende metal-bærbar tryksensor til sundhedsovervågningsapplikationer
- Nanopartikler kan begrænse inflammation ved at distrahere immunsystemet
- Besked til EU:Du har chancen for at stoppe med at sætte skub i ødelæggelserne i Amazon
- Hvorfor falder en tung genstand med samme hastighed som lys i vakuum?


