Hvad menes med en hydrofob aminosyre?
Her er grunden til, at dette er vigtigt:
* Proteinfoldning: Hydrofobe aminosyrer spiller en afgørende rolle i proteinfoldning. De har en tendens til at klynge sig sammen i det indre af proteinet væk fra det vandige miljø omkring cellen. Dette skaber en stabil, hydrofob kerne, der hjælper proteinet med at bevare sin form.
* Proteinfunktion: Hydrofobe interaktioner er også vigtige for protein-proteininteraktioner og bindingen af ligander (molekyler, der binder til proteiner). For eksempel kan hydrofobe aminosyrer på det aktive sted for et enzym hjælpe med at binde et hydrofobt substrat.
Eksempler på hydrofobe aminosyrer:
* alanin (ala, a)
* Valine (Val, V)
* leucin (leu, l)
* isoleucin (ile, i)
* methionin (Met, M)
* phenylalanin (Phe, F)
* tryptophan (Trp, W)
* proline (pro, p)
Hvad gør disse aminosyrer hydrofobe?
* ikke -polære sidekæder: De har sidekæder, der for det meste er carbonhydridbaserede (indeholdende carbon- og hydrogenatomer). Disse sidekæder tiltrækkes ikke af vandmolekyler, som er polære.
* Hydrofobe interaktioner: Hydrofobe aminosyrer har en tendens til at interagere med hinanden gennem svage, ikke-kovalente kræfter kaldet hydrofobe interaktioner. Disse interaktioner hjælper med at drive foldning og samling af proteiner.
I modsætning til hydrofobe aminosyrer, hydrofile aminosyrer Er tiltrukket af vand og findes typisk på overfladen af proteiner, hvor de kan interagere med det omgivende vandige miljø.
Sidste artikelHvad er et ikke -eksempel på smeltning?
Næste artikelHvad er det ædle lette element, der bruges af Goodyear?
 Varme artikler
Varme artikler
-
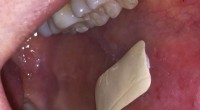 Gips, der sidder inde i munden, kan forbedre behandlingen af orale tilstandeDet bionedbrydelige plaster sidder inde i munden og hjælper med at fremskynde behandlingen af smertefulde sår Kredit:University of Sheffield Et gips, der klæber til indersiden af din mund, rev
Gips, der sidder inde i munden, kan forbedre behandlingen af orale tilstandeDet bionedbrydelige plaster sidder inde i munden og hjælper med at fremskynde behandlingen af smertefulde sår Kredit:University of Sheffield Et gips, der klæber til indersiden af din mund, rev -
 Brug af aluminium og lasere til at lave bøjeligt glasFremgangsmåde til fremstilling af det duktile glas. Pulserende laseraflejring:højenergiske laserimpulser skydes til det krystallinske mål i venstre side af billedet. Den intense energi nedbryder det k
Brug af aluminium og lasere til at lave bøjeligt glasFremgangsmåde til fremstilling af det duktile glas. Pulserende laseraflejring:højenergiske laserimpulser skydes til det krystallinske mål i venstre side af billedet. Den intense energi nedbryder det k -
 Et beskyttende skjold til følsomme enzymer i biobrændstofcellerBiobrændselscelletestene blev udført i denne elektrokemiske celle. Kredit:Ruhr-Universitaet-Bochum Et internationalt team af forskere har udviklet en ny mekanisme til at beskytte enzymer mod ilt s
Et beskyttende skjold til følsomme enzymer i biobrændstofcellerBiobrændselscelletestene blev udført i denne elektrokemiske celle. Kredit:Ruhr-Universitaet-Bochum Et internationalt team af forskere har udviklet en ny mekanisme til at beskytte enzymer mod ilt s -
 Rettelse til synkrotronforskningsfejl kan forbedre resultaterneKurt Nienaber (tv) og Graham George. Kredit:University of Saskatchewan Forskere fra University of Saskatchewan har fundet ud af, at kemikalier, der normalt bruges til at beskytte prøver i synkrotr
Rettelse til synkrotronforskningsfejl kan forbedre resultaterneKurt Nienaber (tv) og Graham George. Kredit:University of Saskatchewan Forskere fra University of Saskatchewan har fundet ud af, at kemikalier, der normalt bruges til at beskytte prøver i synkrotr
- Hvordan en formskiftende DNA-reparationsmaskine bekæmper kræft
- Har du en sød tand? Honningbier klo
- Hvad er inskriptionshypotesen ved udånding?
- NASA-værktøjet forbereder sig på at afbilde fjerne planeter
- Hvorfor styrte jorden ind i solen?
- Hvem var herskeren over Pompeji om tiden stort udbrud i 79 e.Kr.


