Hvilke værdier klassificerer bedst et binding mellem 2 atomer, der er kovalente?
Elektronegativitetsforskel
* lille elektronegativitetsforskel: Den mest afgørende faktor! Kovalente bindinger formes mellem atomer med lignende elektronegativitetsværdier .
* Elektronegativitet er et mål for et atoms evne til at tiltrække elektroner i en binding.
* Når forskellen i elektronegativitet er lille (typisk mindre end 1,7 i Pauling -skalaen), deles elektronerne relativt ligeligt mellem atomerne, hvilket resulterer i en kovalent binding.
Andre overvejelser
* obligationstype: Kovalente obligationer klassificeres normalt som:
* ikke -polær kovalent: Elektroner deles lige (identiske atomer eller meget ens elektronegativitet).
* polær kovalent: Elektroner deles ulige (forskellig elektronegativitet, men stadig mindre end 1,7). Dette skaber en let positiv og negativ ladning på atomerne og danner et dipolmoment.
* Bond Energy: Kovalente bindinger har generelt højere bindingsenergier end ioniske bindinger. Dette betyder, at der kræves mere energi for at bryde båndet.
Eksempler
* H₂ (brintgas): Begge hydrogenatomer har den samme elektronegativitet, hvilket resulterer i en ikke -polær kovalent binding.
* h₂o (vand): Oxygen er mere elektronegativ end brint, hvilket fører til en polær kovalent binding. Oxygenatomet bærer en let negativ ladning, mens brintatomerne har en let positiv ladning.
Vigtig note: Mens elektronegativitetsforskellen er den primære indikator, er der andre faktorer, der kan påvirke obligationstypen. For eksempel kan tilstedeværelsen af flere obligationer (dobbelt- eller tredobbelt obligationer) styrke bindingen og gøre den mere kovalent i karakter.
Fortæl mig, hvis du gerne vil have flere detaljer om specifikke eksempler eller vil udforske nuancerne ved at binde yderligere!
Sidste artikelEr svovlopløselig i carbontetrachlorid?
Næste artikelHvilke molekyler bruges til at fremstille kulhydrater?
 Varme artikler
Varme artikler
-
 Ny måde at danne bioaktiv edderkoppesilke til medicinsk brugFor at skabe nanotråde placerede forskerne en dråbe på overfladen, og trak derefter dråben sideværts, efterlader tråde af materialet, der spænder over søjlerne. Kredit:KTH Kgl. Teknologisk Institut
Ny måde at danne bioaktiv edderkoppesilke til medicinsk brugFor at skabe nanotråde placerede forskerne en dråbe på overfladen, og trak derefter dråben sideværts, efterlader tråde af materialet, der spænder over søjlerne. Kredit:KTH Kgl. Teknologisk Institut -
 Forskere udvikler en ny metode til at overvåge molekylær aggregeringSimulerede kirotiske egenskaber kontra dihedral vinkel θ af (R)1, 1-binaphthyl. Kredit:Hong Kong University of Science and Technology Chirale molekyler er defineret som molekyler, der ikke kan ove
Forskere udvikler en ny metode til at overvåge molekylær aggregeringSimulerede kirotiske egenskaber kontra dihedral vinkel θ af (R)1, 1-binaphthyl. Kredit:Hong Kong University of Science and Technology Chirale molekyler er defineret som molekyler, der ikke kan ove -
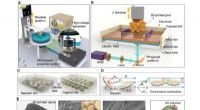 3D-udskrivning elektrisk understøttet, nacre-inspirerede strukturer med selvfølende evnerSkematisk diagram over den elektrisk assisterede 3D-printplatform til konstruktion af nacre-inspirerede strukturer. (A) Diagram over den elektrisk assisterede 3D-udskrivningsenhed. (B) Illustration af
3D-udskrivning elektrisk understøttet, nacre-inspirerede strukturer med selvfølende evnerSkematisk diagram over den elektrisk assisterede 3D-printplatform til konstruktion af nacre-inspirerede strukturer. (A) Diagram over den elektrisk assisterede 3D-udskrivningsenhed. (B) Illustration af -
 Kompleks stofskifte kan have samlet sig selv fra simple prækursorerEn reaktion af thioeddikesyre, thioler og jernproducerende thioestere og et jernsulfidmineral. Kredit:Sebastian Sanden, ELSI. Alt moderne liv bruger energi til at reproducere sig selv. Under denne
Kompleks stofskifte kan have samlet sig selv fra simple prækursorerEn reaktion af thioeddikesyre, thioler og jernproducerende thioestere og et jernsulfidmineral. Kredit:Sebastian Sanden, ELSI. Alt moderne liv bruger energi til at reproducere sig selv. Under denne
- ATLAS Eksperiment søger efter sjældne Higgs boson henfalder til en foton og en Z boson
- Hvor mange fyrretræer blod indeholder den menneskelige krop?
- Hvad er funktionerne i mikrofilamenter og mikrotubuli?
- Højeste effektivitet af fleksibel CZTSSe tyndfilm solcelle opnået
- Hvad er en del Icles kaldet den bevægelse virkelig hurtigt?
- Kærlighed i coronatiden:Hvordan pandemien ændrer online dating


