Hvorfor er jod næsten uopløselig i vand, men det opløses let vandig opløsning af KI?
jodens uopløselige natur i vand
* ikke -polær natur: Jod (I₂) er et ikke -polært molekyle. Det har en symmetrisk struktur med en relativt svag tiltrækning mellem jodatomerne.
* Polar karakter af vand: Vand (H₂O) er et meget polært molekyle. Dens brintatomer har en delvis positiv ladning, og dets iltatom har en delvis negativ ladning.
* "som opløser som": Princippet om "som opløser som" dikterer, at polære opløsningsmidler opløser polære opløste stoffer, og ikke -polære opløsningsmidler opløser ikke -polære opløste stoffer. Da jod er ikke -polært og vand er polært, blander de ikke godt, hvilket fører til lav opløselighed.
opløselighedsforøgelse med kaliumiodid (KI)
* Dannelse af triiodidioner (i₃⁻): Når jod (I₂) tilsættes til en opløsning af kaliumiodid (KI), reagerer det med iodidionerne (i⁻), der er til stede i opløsningen. Denne reaktion danner triiodidioner (I₃⁻).
* ligevægt: Reaktionen er en ligevægtsproces:
I₂ (S) + i⁻ (aq) ⇌ i₃⁻ (aq)
* skiftende ligevægt: Dannelsen af triiodidioner favoriseres, fordi triiodidionen er en større og mere polariserbar art end jod. Dette betyder, at triiodidionen kan interagere stærkere med de polære vandmolekyler, hvilket øger opløseligheden.
* samlet effekt: Reaktionen fjerner effektivt jod fra opløsningen, når den danner triiodidioner, kører ligevægten til højre og giver mere jod mulighed for at opløses.
Kortfattet:
Tilsætningen af kaliumiodid giver en måde for jod at interagere med vandmolekyler mere fordelagtigt ved at danne triiodidioner, som er mere polariserbare og kan interagere bedre med de polære vandmolekyler. Dette resulterer i en markant stigning i jodens opløselighed.
Sidste artikelHvad er stofferne i kapselrummet?
Næste artikelHvilken form er molekylet i3?
 Varme artikler
Varme artikler
-
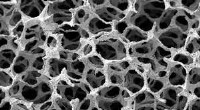 Metallisk skum kan opsuge lyd under højt tryk, miljøer med høje temperaturer såsom jetmotorerEt scanningselektronmikrofotografi af det nikkelbaserede superlegering med åbne celler. Kredit:Singapore Institute of Manufacturing Technology Superlegeringsskum kunne gøre skibs- og flymotorer me
Metallisk skum kan opsuge lyd under højt tryk, miljøer med høje temperaturer såsom jetmotorerEt scanningselektronmikrofotografi af det nikkelbaserede superlegering med åbne celler. Kredit:Singapore Institute of Manufacturing Technology Superlegeringsskum kunne gøre skibs- og flymotorer me -
 Identificeret:Molekylær struktur, der nedbryder en vigtig komponent i smogKredit:Pacific Northwest National Laboratory Kvælstofoxider, også kendt som NO x , dannes, når fossile brændstoffer brænder ved høje temperaturer. Når de udsendes fra industrielle kilder, såsom
Identificeret:Molekylær struktur, der nedbryder en vigtig komponent i smogKredit:Pacific Northwest National Laboratory Kvælstofoxider, også kendt som NO x , dannes, når fossile brændstoffer brænder ved høje temperaturer. Når de udsendes fra industrielle kilder, såsom -
 Forskere udvikler 3-D printsubstrat med dynamiske bindinger til justerbare egenskaber4-D-print:En farve- og formskiftende blomst i mikrostørrelse skabt ved direkte laserskrivning. Kredit:TU/e Fantastiske former kan laves ved hjælp af 3-D print, men til mange applikationer skal det
Forskere udvikler 3-D printsubstrat med dynamiske bindinger til justerbare egenskaber4-D-print:En farve- og formskiftende blomst i mikrostørrelse skabt ved direkte laserskrivning. Kredit:TU/e Fantastiske former kan laves ved hjælp af 3-D print, men til mange applikationer skal det -
 Med denne nye alfa-gel, cremen af alle hudcremer kunne være herForskere fra Tokyo University of Science udvikler et miljøvenligt og let producereligt overfladeaktivt middel til at lave en effektiv vandfastholdende blanding, der kan bruges i hudpleje Kredit:Tokyo
Med denne nye alfa-gel, cremen af alle hudcremer kunne være herForskere fra Tokyo University of Science udvikler et miljøvenligt og let producereligt overfladeaktivt middel til at lave en effektiv vandfastholdende blanding, der kan bruges i hudpleje Kredit:Tokyo
- Hvordan rengøres elektriske komfurelementer?
- Rollerosoler spiller i klimaforandringerne låst op af spektakulære islandske vulkanudbrud
- Hvad er breddegrad og længdegrad af Mount Pinatubo?
- Hvad hedder Layered Rock?
- Et konvolutionsnetværk til at justere og forudsige følelseskommentarer
- Hologrameksperter kan nu skabe virkelige billeder, der bevæger sig i luften


