Hvilke grupper af elementer på den periodiske tabel er meget reaktive?
* gruppe 1:Alkali Metals (Li, Na, K, RB, CS, FR) - Disse metaller har kun en valenselektron, hvilket gør dem meget reaktive. De mister let dette elektron til dannelse af +1 kationer, der reagerer kraftigt med vand, ilt og andre ikke -metaller.
* gruppe 2:Alkaliske jordmetaller (BE, MG, CA, SR, BA, RA) - Disse metaller har to valenselektroner og er også meget reaktive, skønt de er mindre end alkalimetaller. De reagerer let med vand og ilt og danner +2 kationer.
Andre grupper med bemærkelsesværdig reaktivitet:
* gruppe 17:halogener (F, CL, BR, I, AT) - Disse ikke -metaller har syv valenselektroner og er meget reaktive. De får let en elektron til dannelse af -1 anioner, der reagerer kraftigt med metaller og andre ikke -metaller.
* gruppe 16:chalcogens (O, S, SE, TE, PO) - Disse ikke -metaller har seks valenselektroner og er mindre reaktive end halogener, men stadig meget reaktive. De får let to elektroner til dannelse af -2 anioner.
Det er vigtigt at bemærke, at reaktivitet er et relativt koncept , og endda inden for en gruppe ændrer reaktiviteten sig. F.eks. Er fluor (F) den mest reaktive halogen, mens astatin (AT) er den mindst reaktive.
Sidste artikelHvordan er kemi involveret i felttoksikologien?
Næste artikelMindst reaktivt metal i gruppe 1 i den periodiske tabel?
 Varme artikler
Varme artikler
-
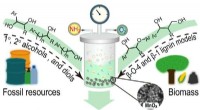 Ny strategi muliggør successiv spaltning og funktionalisering af C–C-bindinger i alkoholerSkematiske illustrationer af manganoxid til katalytisk spaltning og funktionalisering af alkoholreaktion. Kredit:He Peipei Et forskerhold ledet af prof. Dai Wen fra Dalian Institute of Chemical Phy
Ny strategi muliggør successiv spaltning og funktionalisering af C–C-bindinger i alkoholerSkematiske illustrationer af manganoxid til katalytisk spaltning og funktionalisering af alkoholreaktion. Kredit:He Peipei Et forskerhold ledet af prof. Dai Wen fra Dalian Institute of Chemical Phy -
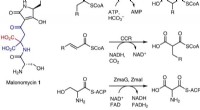 Forskere opdager en ny vej til antibiotika ved hjælp af genredigeringen, Malonomycin 1 indeholder en intakt aminomalonatdel. b, Biosyntese af malonater i primær og sekundær metabolisme (R = H eller alkyl). c, Foreslået mekanisme af pattedyret VKDC. Phylloquinoner (vita
Forskere opdager en ny vej til antibiotika ved hjælp af genredigeringen, Malonomycin 1 indeholder en intakt aminomalonatdel. b, Biosyntese af malonater i primær og sekundær metabolisme (R = H eller alkyl). c, Foreslået mekanisme af pattedyret VKDC. Phylloquinoner (vita -
 Redesigner håndsprit og donerer 7, 000 gallons til at bekæmpe COVID-19Håndsprit reddet af ethanol. Et velgørende initiativ kørte for at forhindre håndsprit i at løbe kritisk lavt over hele landet. Kredit:Georgia Tech/Christopher Moore Så mange mennesker, Seth Marder
Redesigner håndsprit og donerer 7, 000 gallons til at bekæmpe COVID-19Håndsprit reddet af ethanol. Et velgørende initiativ kørte for at forhindre håndsprit i at løbe kritisk lavt over hele landet. Kredit:Georgia Tech/Christopher Moore Så mange mennesker, Seth Marder -
 Boblefangst overflade hjælper med at slippe af med skumI to identiske bægerglas med en konstant strøm af bobler, ved at indsætte et stykke af det nye teksturerede materiale, der er udviklet af MIT -teamet (til højre), får skumdannelsen i toppen af bæger
Boblefangst overflade hjælper med at slippe af med skumI to identiske bægerglas med en konstant strøm af bobler, ved at indsætte et stykke af det nye teksturerede materiale, der er udviklet af MIT -teamet (til højre), får skumdannelsen i toppen af bæger
- Hvordan frostvæskeproteiner får iskrystaller til at vokse
- Reduktion af metanemissioner kan spille en central rolle i reduktionen af ozon på verdensplan
- Entomolog forklarer, hvorfor du ikke bør dræbe edderkopper i dit hjem
- MXene-materialer hjælper fotodetektorer med at se lyset
- Hvorfor vejrudsigten altid vil være en smule forkert
- Sådan holder du pennen mægtig i den digitale tidsalder


