Hvad er semimetalsreaktivitet?
Karakteristika ved semimetalreaktivitet:
* Mellemreaktivitet: Semimetaler er generelt mindre reaktive end metaller, men mere reaktive end ikke -metaller. De kan deltage i både ionisk og kovalent binding, afhængigt af det specifikke element og reaktionsbetingelserne.
* Variabel oxidation siger: Semimetaler kan danne forbindelser med forskellige oxidationstilstande, hvilket betyder, at de kan miste eller få forskellige antal elektroner. Dette giver dem større alsidighed ved dannelse af kemiske bindinger.
* amfoterisk natur: Nogle semimetaler, som arsen og antimon, udviser amfoterisk opførsel. De kan reagere med både syrer og baser, der fungerer som både et metal og et ikke -metal afhængigt af omstændighederne.
* halvledere: Et definerende kendetegn ved semimetaler er deres evne til at udføre elektricitet under specifikke forhold. Denne ledningsevne er generelt svagere end metaller, men stærkere end ikke -metaller. Denne unikke elektriske ejendom gør dem værdifulde inden for elektronik og halvlederteknologi.
Eksempler på semimetalreaktivitet:
* silicium (SI): Brugt til fremstilling af halvledere, glas og keramik. Silicium reagerer med ilt for at danne siliciumdioxid (SiO2), en vigtig komponent af sand.
* germanium (GE): Brugt i transistorer og solceller. Germanium reagerer med halogener for at danne tetrahalider.
* arsen (som): Giftigt element fundet i pesticider og nogle legeringer. Arsen reagerer med ilt for at danne arsentrioxid (AS2O3).
* antimon (SB): Brugt i batterier, flammehæmmere og legeringer. Antimon reagerer med svovl for at danne antimonsulfid (SB2S3), en komponent af nogle pigmenter.
* tellurium (TE): Bruges i solcellepaneler og som en komponent af legeringer. Tellurium reagerer med ilt for at danne telluriumdioxid (TEO2), et halvledermateriale.
Konklusion:
Semimetals demonstrerer et komplekst og fascinerende vifte af reaktivitet, der ofte udviser karakteristika for både metaller og ikke -metaller. Denne unikke opførsel har gjort dem vigtige i forskellige teknologiske anvendelser, især inden for elektronik og halvledere. Deres mellemreaktivitet giver dem mulighed for at deltage i en lang række kemiske reaktioner, hvilket gør dem alsidige elementer i den periodiske tabel.
Sidste artikelHvad er katalysatoren for smog-dannende reaktioner?
Næste artikelHvorfor er cyclopentan uopløselig i vand?
 Varme artikler
Varme artikler
-
 Ren teknologi til fremstilling af lavmolekylær chitosanPlasma-assisteret depolymerisation af chitosan i en kvartsblandingsanordning. Kredit:MIPT Forskere ved MIPT har udviklet en ny teknik til at opnå lavmolekylær vægt, vandopløseligt kitin og chitosa
Ren teknologi til fremstilling af lavmolekylær chitosanPlasma-assisteret depolymerisation af chitosan i en kvartsblandingsanordning. Kredit:MIPT Forskere ved MIPT har udviklet en ny teknik til at opnå lavmolekylær vægt, vandopløseligt kitin og chitosa -
 Ultra-præcision nano-sensor kunne opdage jernlidelserDr. Pooria Lesani, Universitetet i Sydney. Kredit:Dr Pooria Lesani, Universitetet i Sydney Kroniske jernubalancer – enten for lidt eller for meget jern i blodet – kan resultere i medicinske tilsta
Ultra-præcision nano-sensor kunne opdage jernlidelserDr. Pooria Lesani, Universitetet i Sydney. Kredit:Dr Pooria Lesani, Universitetet i Sydney Kroniske jernubalancer – enten for lidt eller for meget jern i blodet – kan resultere i medicinske tilsta -
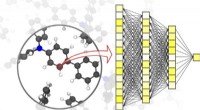 Maskinlæring fremskynder simuleringer inden for materialevidenskabNeurale netværk muliggør præcise simuleringer inden for materialevidenskab – ned til niveauet af individuelle atomer. Kredit:Pascal Friedrich, SÆT Forskning, udvikling, og produktion af nye materi
Maskinlæring fremskynder simuleringer inden for materialevidenskabNeurale netværk muliggør præcise simuleringer inden for materialevidenskab – ned til niveauet af individuelle atomer. Kredit:Pascal Friedrich, SÆT Forskning, udvikling, og produktion af nye materi -
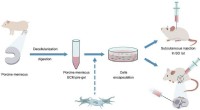 Forskere udvikler injicerbare ekstracellulære matrix-baserede biomaterialer til meniskreparationSkematisk diagram af injicerbar ECM-hydrogel til levering af BMSCer. Kredit:SIAT Menisken er et tyndt lag af bindevæv i menneskelige knæ, der hjælper med at opretholde stabiliteten af led og udf
Forskere udvikler injicerbare ekstracellulære matrix-baserede biomaterialer til meniskreparationSkematisk diagram af injicerbar ECM-hydrogel til levering af BMSCer. Kredit:SIAT Menisken er et tyndt lag af bindevæv i menneskelige knæ, der hjælper med at opretholde stabiliteten af led og udf
- Astronomer foreslår en ny metode til at finde atmosfærer på klippeverdener
- Video:Hvad er en elektron?
- Frøer afslører mekanisme, der bestemmer hybrids levedygtighed
- Forskellen mellem en joviansk planet og en terraansk planet?
- Mindre, stærkere magneter kan forbedre enheder, der udnytter fusionskraften fra solen og stjernerne
- Satellit viser, at post-tropisk cyklon Selma forsvinder


