Hvilke grupper af elementer har forskellige anklager?
Her er hvorfor:
* Overgangsmetaller: Disse elementer er placeret i D-blokken i den periodiske tabel. De har variable afgifter, fordi de kan miste elektroner fra både deres yderste s orbital og deres d orbital. Denne fleksibilitet giver dem mulighed for at danne flere kationer (positivt ladede ioner) med forskellige afgifter. For eksempel kan jern (Fe) danne Fe²⁺⁺ og Fe³⁺ -ioner.
* Metaller efter overgang: Disse elementer er placeret i p-blokken i den periodiske tabel, specifikt i grupper 13-16. Mens de ikke har det samme omfattende udvalg af afgifter som overgangsmetaller, kan de stadig danne flere oxidationstilstande (afgifter). For eksempel kan tin (Sn) danne sn²⁺ og sn⁴⁺ioner.
Hvorfor andre elementer har rettede gebyrer:
* alkalimetaller (gruppe 1): De har en valenselektron og har en tendens til at miste den for at danne en +1 ladning.
* alkaliske jordmetaller (gruppe 2): De har to valenselektroner og har en tendens til at miste dem til at danne en +2 ladning.
* halogener (gruppe 17): De har syv valenselektroner og har en tendens til at få et elektron til dannelse af en -1 -ladning.
* ædle gasser (gruppe 18): De har en fuld ydre skal af elektroner og er generelt ureaktive, så de danner ikke let ioner.
Vigtig note: Selv inden for overgangsmetaller og metaller efter overgang, kan de specifikke ladninger, et element kan have, afhænge af forbindelsen, den danner, og andre faktorer som tilstedeværelsen af ligander.
Sidste artikelForklar, hvorfor de lysuafhængige reaktioner kaldes, såsom?
Næste artikelHvilken fase er flydende nitrogen ved stuetemperatur?
 Varme artikler
Varme artikler
-
 Ny opdagelse hjælper myndighederne med at identificere heroinets oprindelseFIU kemi Ph.D. studerende Joshua DeBord analyserer en heroinprøve ved hjælp af udstyr på University of Miami. Kredit:Florida International University Forskere ved Florida International Universitys
Ny opdagelse hjælper myndighederne med at identificere heroinets oprindelseFIU kemi Ph.D. studerende Joshua DeBord analyserer en heroinprøve ved hjælp af udstyr på University of Miami. Kredit:Florida International University Forskere ved Florida International Universitys -
 Video:Hvor meget vejer en sky?Kredit:The American Chemical Society Forestil dig 300 mellemstore biler, der flyder over dit hoved - sådan vejer din gennemsnitlige luftige sky. Så hvorfor styrter det ikke ned på dig? Denne ug
Video:Hvor meget vejer en sky?Kredit:The American Chemical Society Forestil dig 300 mellemstore biler, der flyder over dit hoved - sådan vejer din gennemsnitlige luftige sky. Så hvorfor styrter det ikke ned på dig? Denne ug -
 Ny indsigt i større sygdomsforløbKredit:CC0 Public Domain Flinders forskere har gjort store indgreb i at finde årsagen til hjertesygdomme, Alzheimers, Kræft, diabetes og andre sygdomme efter at have opdaget yderligere 148 protein
Ny indsigt i større sygdomsforløbKredit:CC0 Public Domain Flinders forskere har gjort store indgreb i at finde årsagen til hjertesygdomme, Alzheimers, Kræft, diabetes og andre sygdomme efter at have opdaget yderligere 148 protein -
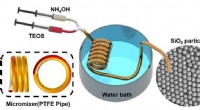 Forskere bruger et teflonrør til at lave en billig, simpel reaktor til silicapartikelsynteseEksperimentel opsætning af mikrofluidisk mixer til syntese af silica. Kredit:Yang Hui Forskere i Australien og Kina har foreslået en innovativ og omkostningseffektiv ny metode til at skabe silicap
Forskere bruger et teflonrør til at lave en billig, simpel reaktor til silicapartikelsynteseEksperimentel opsætning af mikrofluidisk mixer til syntese af silica. Kredit:Yang Hui Forskere i Australien og Kina har foreslået en innovativ og omkostningseffektiv ny metode til at skabe silicap


