Et magnesiumatom har 12 elektroner. Når det reagerer, mister normalt 2, hvordan gør dette tab mere stabilt?
* Elektronkonfiguration: Magnesium (Mg) har en elektronkonfiguration på 1S² 2s² 2p⁶ 3S². Den yderste skal (3S) har kun to elektroner.
* octet regel: Atomer stræber efter at opnå en stabil konfiguration med en fuld ydre skal af elektroner, typisk otte (Octet -reglen).
* ionisering: Ved at miste sine to 3S -elektroner bliver magnesium en positivt ladet ion (mg²⁺). Den resterende elektronkonfiguration er 1S² 2s² 2p⁶, som er den samme som neon, en ædel gas med en fuld ydre skal.
* stabilitet: Denne fulde ydre skal er ekstremt stabil, hvilket gør magnesiumionen mindre reaktiv og mere stabil end det neutrale magnesiumatom.
Kortfattet:
At miste to elektroner giver magnesium mulighed for at opnå den stabile elektronkonfiguration af en ædel gas, hvilket resulterer i en mere stabil tilstand.
Sidste artikelHvilke to lag er ozonlaget mellem?
Næste artikelHvor mange flere valenselektroner skal ilt have en fuld ydre?
 Varme artikler
Varme artikler
-
 En ny måde at se, om der er genbrugsmateriale i den plastikflaske eller -poseTilføjelse af et fluorescerende mærke til genbrugsplast kan hjælpe med at spore deres mængde i nye engangsprodukter. Kredit:Tilpasset fra ACS Sustainable Chemistry &Engineering 2022 For at tilskynd
En ny måde at se, om der er genbrugsmateriale i den plastikflaske eller -poseTilføjelse af et fluorescerende mærke til genbrugsplast kan hjælpe med at spore deres mængde i nye engangsprodukter. Kredit:Tilpasset fra ACS Sustainable Chemistry &Engineering 2022 For at tilskynd -
 Ny antiviral, antibakteriel overflade kan reducere spredning af infektioner på hospitalerKredit:CC0 Public Domain Den nye coronavirus-pandemi har forårsaget en øget efterspørgsel efter antimikrobielle behandlinger, der kan holde overflader rene, især i sundhedsvæsenet. Selvom der er u
Ny antiviral, antibakteriel overflade kan reducere spredning af infektioner på hospitalerKredit:CC0 Public Domain Den nye coronavirus-pandemi har forårsaget en øget efterspørgsel efter antimikrobielle behandlinger, der kan holde overflader rene, især i sundhedsvæsenet. Selvom der er u -
 Karakterisering af proteinkondensaters tidsafhængige materialeegenskaberProteindråber udviser aldersafhængige materialeegenskaber. Kredit: Videnskab (2020). DOI:10.1126/science.aaw4951 Et team af forskere tilknyttet flere institutioner i Tyskland og Østrig har udvikl
Karakterisering af proteinkondensaters tidsafhængige materialeegenskaberProteindråber udviser aldersafhængige materialeegenskaber. Kredit: Videnskab (2020). DOI:10.1126/science.aaw4951 Et team af forskere tilknyttet flere institutioner i Tyskland og Østrig har udvikl -
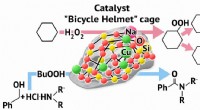 Chemist udvikler en ny katalysator til oxidation og amideringEn RUDN-kemiker udviklede en ny katalysator for oxidation og amidering Kredit:Allen Dressen En RUDN-kemiker har fået en forbindelse med en ny strukturel type, der indeholder atomer af metaller (ko
Chemist udvikler en ny katalysator til oxidation og amideringEn RUDN-kemiker udviklede en ny katalysator for oxidation og amidering Kredit:Allen Dressen En RUDN-kemiker har fået en forbindelse med en ny strukturel type, der indeholder atomer af metaller (ko
- Hvordan luftforurening ændrede sig under COVID-19 i Park City, Utah
- Teknologi til at detektere kemikalier i frugt og grøntsager
- Hvad er forskellen mellem mineraler og fossile brændstoffer?
- Electrophoresis Process
- Betydningen af jordforurening
- Pakistans oversvømmelser:Hvilken rolle spillede klimaforandringerne?


