Hvad er Readox -reaktion?
redoxreaktioner er kemiske reaktioner, der involverer overførsel af elektroner mellem to arter. Udtrykket "redox" er en kombination af "reduktion" og "oxidation."
Her er en sammenbrud:
* Oxidation: Tab af elektroner af en art. En art, der gennemgår oxidation, kaldes reduktionsmiddel Fordi det får de andre arter til at blive reduceret.
* reduktion: Gevinst af elektroner af en art. En art, der gennemgår reduktion, kaldes oxiderende middel Fordi det får de andre arter til at blive oxideret.
Nøglepunkter om redoxreaktioner:
* De forekommer altid sammen. Hvis en art oxideres, skal en anden reduceres.
* Antallet af mistede elektroner i oxidation skal svare til antallet af elektroner, der er opnået i reduktion.
* De er vigtige for mange biologiske og industrielle processer, herunder:
* Cellulær respiration: Den proces, hvormed organismer omdanner mad til energi.
* forbrænding: Processen med brændende brændstoffer.
* elektrolyse: Brug af elektricitet til at drive ikke-spontane kemiske reaktioner.
* Korrosion: Forringelse af metaller på grund af kemiske reaktioner.
* Fotosyntese: Den proces, hvorpå planter omdanner sollys til energi.
Eksempel:
Overvej reaktionen mellem zinkmetal (Zn) og kobber (II) -ioner (Cu²⁺):
Zn (S) + Cu²⁺ (aq) → Zn²⁺ (aq) + cu (s)
* zink (Zn) oxideres:det mister to elektroner til at blive Zn²⁺.
* kobber (II) ioner (cu²⁺) er reduceret:De får to elektroner til at blive kobbermetal (Cu).
I denne reaktion er zink det reduktionsmiddel, og kobber (II) -ioner er det oxiderende middel.
Fortæl mig, hvis du gerne vil have flere eksempler eller have andre spørgsmål om redoxreaktioner.
Sidste artikelHvorfor findes ikke -metaller ikke i atomform?
Næste artikelEr rustformer på en søm tilbage uden for kemisk forandring?
 Varme artikler
Varme artikler
-
 Et eksempel på plasmoner, der direkte påvirker molekylerExcitationsmekanismer for plasmoninducerede kemiske reaktioner. (A) indirekte hot-elektron overførsel mekanisme. Varme elektroner (e−) genereret via ikke -strålende henfald af en LSP overført til dann
Et eksempel på plasmoner, der direkte påvirker molekylerExcitationsmekanismer for plasmoninducerede kemiske reaktioner. (A) indirekte hot-elektron overførsel mekanisme. Varme elektroner (e−) genereret via ikke -strålende henfald af en LSP overført til dann -
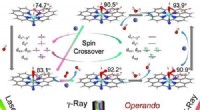 Forskere identificerer elektroniske og strukturelle dynamikker i katalytiske centre i enkelt-Fe-atom…Identifikationen af den elektroniske og strukturelle dynamik af katalytiske centre i enkelt-Fe-atom materiale ved Operando Mossbauer spektroskopi. Kredit:LI Xuning Single-atom catalyst (SAC) er
Forskere identificerer elektroniske og strukturelle dynamikker i katalytiske centre i enkelt-Fe-atom…Identifikationen af den elektroniske og strukturelle dynamik af katalytiske centre i enkelt-Fe-atom materiale ved Operando Mossbauer spektroskopi. Kredit:LI Xuning Single-atom catalyst (SAC) er -
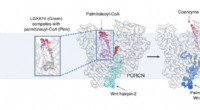 Nye cryo-EM-billeder kaster lys over Wnt-signaleringCryo-EM afslører, hvordan Wnt, et nøglesignalmolekyle for menneskelig udvikling og kræft, modificeres af et enzym ved navn PORCN. Kredit:UT Southwestern Medical Center Ved hjælp af UT Southwesterns
Nye cryo-EM-billeder kaster lys over Wnt-signaleringCryo-EM afslører, hvordan Wnt, et nøglesignalmolekyle for menneskelig udvikling og kræft, modificeres af et enzym ved navn PORCN. Kredit:UT Southwestern Medical Center Ved hjælp af UT Southwesterns -
 En demonstration af billeddannelse i det virkelige rum af nogle af de mest repræsentative former fo…Den skematiske model af solvatiserede protoner i enkeltlagsvand. Blå:solvatiserede protoner af Zundel-typen; Rød:vandmolekyler; Gul:guld substrat. Kredit:Ying Jiang, Peking University Et team af fo
En demonstration af billeddannelse i det virkelige rum af nogle af de mest repræsentative former fo…Den skematiske model af solvatiserede protoner i enkeltlagsvand. Blå:solvatiserede protoner af Zundel-typen; Rød:vandmolekyler; Gul:guld substrat. Kredit:Ying Jiang, Peking University Et team af fo
- Forsuring hæmmer skaludviklingen af plankton ud for den amerikanske vestkyst
- Videnskabenavnernes betydning for organismer
- Er fremskridt robuste nok til at levere på brints enorme potentiale?
- Radio gjorde den berømte finske komponist Jean Sibelius til en international mediefigur, siger fors…
- Hvordan vil Starlinks pakkerouting fungere?
- Hvorfor tog det så lang tid at opdage Planet Nine?


