Hvad er forskellige faktorer, der påvirker hastighederne for kemiske reaktioner?
faktorer, der påvirker kemiske reaktionshastigheder
Hastigheden for en kemisk reaktion bestemmes af, hvor hurtigt reaktanterne omdannes til produkter. Her er nogle nøglefaktorer, der påvirker denne sats:
1. Koncentration af reaktanter:
* Højere koncentration: Flere reaktantmolekyler er til stede, hvilket fører til hyppigere kollisioner og dermed en hurtigere reaktionshastighed.
* lavere koncentration: Færre kollisioner forekommer, hvilket resulterer i en langsommere reaktionshastighed.
2. Temperatur:
* Højere temperatur: Molekyler bevæger sig hurtigere, hvilket fører til hyppigere og energiske kollisioner. Dette øger sandsynligheden for, at obligationer bryder og dannes, fremskynder reaktionen.
* lavere temperatur: Molekyler bevæger sig langsommere, hvilket resulterer i færre og mindre energiske kollisioner, hvilket fører til en langsommere reaktionshastighed.
3. Overfladeareal af reaktanter:
* større overfladeareal: Flere reaktantmolekyler udsættes for kontakt, hvilket fører til hyppigere kollisioner og en hurtigere reaktionshastighed. Dette er især vigtigt for heterogene reaktioner (reaktioner, der involverer faste stoffer og væsker eller gasser).
* mindre overfladeareal: Færre reaktantmolekyler udsættes, hvilket fører til en langsommere reaktionshastighed.
4. Tilstedeværelse af en katalysator:
* katalysator: Et stof, der fremskynder en reaktion uden at blive konsumeret i processen. Katalysatorer giver en alternativ reaktionsvej med en lavere aktiveringsenergi, der gør det muligt for reaktionen at fortsætte hurtigere.
* Inhibitor: Et stof, der bremser en reaktionshastighed. De kan blokere aktive steder på katalysatorer eller forstyrre reaktionsmekanismen.
5. Reaktanters art:
* Kemiske bindinger: Styrken af kemiske bindinger i reaktanter påvirker reaktionshastigheden. Svagere obligationer bryder lettere, hvilket fører til hurtigere reaktioner.
* molekylær struktur: Komplekse molekyler reagerer ofte langsommere på grund af deres steriske hindring (molekylernes vanskeligheder til at kollidere i en gunstig orientering).
6. Tryk (for gasformige reaktioner):
* Højere pres: Forøget tryk for gasformige reaktioner fører til en højere koncentration af reaktanter, hvilket resulterer i hyppigere kollisioner og en hurtigere reaktionshastighed.
* lavere tryk: Nedsat tryk fører til en lavere koncentration af reaktanter, hvilket resulterer i færre kollisioner og en langsommere reaktionshastighed.
7. Lys (til fotokemiske reaktioner):
* lys: Nogle reaktioner initieres af lys, hvilket giver den energi, der er nødvendig for at bryde bindinger og starte reaktionen.
8. Omrøring/agitation:
* omrøring/agitation: Øger kollisionshastigheden ved at sikre, at reaktanter er jævnt fordelt og ved at fjerne produkter fra reaktionszonen.
At forstå disse faktorer er afgørende for at kontrollere og optimere kemiske reaktioner i forskellige anvendelser, såsom industrielle processer, biologiske systemer og hverdagen.
 Varme artikler
Varme artikler
-
 Omdannelse af CO2 til myresyre ved hjælp af en aluminiumoxid-understøttet, jernbaseret forbindelseEt udbredt jordmineral, alfa-jern-(III)-oxyhydroxid, viste sig at blive en genanvendelig katalysator for kuldioxid-fotoreduktion til myresyre. Kredit:Professor Kazuhiko Maeda Fotoreduktion af CO2 t
Omdannelse af CO2 til myresyre ved hjælp af en aluminiumoxid-understøttet, jernbaseret forbindelseEt udbredt jordmineral, alfa-jern-(III)-oxyhydroxid, viste sig at blive en genanvendelig katalysator for kuldioxid-fotoreduktion til myresyre. Kredit:Professor Kazuhiko Maeda Fotoreduktion af CO2 t -
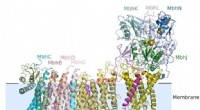 Mikrober fra marine vulkanske ventilationsåbninger afslører, hvordan mennesker tilpassede sig en æ…MBH strukturen. Kredit:Huilin Li, Ph.D., Michael W.W. Adams &Hongjun Yu, Ph.d. Gamle mikrober, der trives i nogle af verdens mest ekstreme miljøer og nutidens mennesker, har mere tilfælles end man
Mikrober fra marine vulkanske ventilationsåbninger afslører, hvordan mennesker tilpassede sig en æ…MBH strukturen. Kredit:Huilin Li, Ph.D., Michael W.W. Adams &Hongjun Yu, Ph.d. Gamle mikrober, der trives i nogle af verdens mest ekstreme miljøer og nutidens mennesker, har mere tilfælles end man -
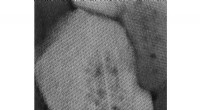 Materialeforskere går nærmere ind på sårbarheder involveret i menneskeligt tandfaldVerdens mindste sandwich. Et atomopløsnings scanningstransmissionselektronmikroskopibillede af en emalje krystallit, der kigger ned ad krystallens lange akse. De mørke områder viser magnesiumioner, de
Materialeforskere går nærmere ind på sårbarheder involveret i menneskeligt tandfaldVerdens mindste sandwich. Et atomopløsnings scanningstransmissionselektronmikroskopibillede af en emalje krystallit, der kigger ned ad krystallens lange akse. De mørke områder viser magnesiumioner, de -
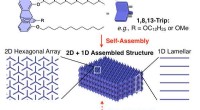 Selvsamlende silikonebaserede polymererFigur 1. Selvsamlende 2D+1D polymerstrukturer. Kredit:©Fumitaka Ishiwari Forskere ved Tokyo Institute of Technology, RIKEN og Tohoku University har udviklet en silikonepolymerkæde, der kan samles
Selvsamlende silikonebaserede polymererFigur 1. Selvsamlende 2D+1D polymerstrukturer. Kredit:©Fumitaka Ishiwari Forskere ved Tokyo Institute of Technology, RIKEN og Tohoku University har udviklet en silikonepolymerkæde, der kan samles
- Hvordan forholder Soma sig til betydningen af autosome og somatiske celler?
- Sådan laver du en kunstig magnet
- Hvad er hastighed målt i et uendeligt lille tidsinterval?
- Dybt under havet, mikrober er aktive og klar til at spise, hvad der end kommer deres vej
- Hvad hedder den smeltede flydende klippe inde i mantelen.?
- Hvordan vibrerer atomer i grafen -nanostrukturer?


