Hvordan adskiller isotoperne fra det givne element fra hinanden?
Her er en sammenbrud:
* atomnummer: Alle isotoper af et givet element har det samme atomnummer, der repræsenterer antallet af protoner i kernen. Det er dette, der definerer selve elementet.
* Massenummer: Isotoper adskiller sig i deres massetal, som er det samlede antal protoner og neutroner i kernen.
* neutroner: Da isotoper af det samme element har det samme antal protoner, kommer forskellen i deres massetal fra det forskellige antal neutroner.
Eksempel:
* carbon-12 har 6 protoner og 6 neutroner (masse nummer =12).
* carbon-14 har 6 protoner og 8 neutroner (massenummer =14).
Begge er kulstof, fordi de har 6 protoner, men de har forskellige antal neutroner, hvilket fører til forskellige massetal.
Nøglepunkter:
* Isotoper har de samme kemiske egenskaber på grund af at have det samme antal elektroner.
* Isotoper kan være stabile eller radioaktive, afhængigt af forholdet mellem neutron og proton.
* Nogle isotoper bruges i forskellige anvendelser, herunder medicin, datatingteknikker og kerneenergi.
 Varme artikler
Varme artikler
-
 Voksende krystaller til at generere tilfældige talKredit: Stof (2020). DOI:10.1016/j.matt.2020.01.024 Et team ved University of Glasgow har udviklet en ny måde at generere tilfældige tal ved at bruge tilfældigheden i krystalvækst. I deres papir
Voksende krystaller til at generere tilfældige talKredit: Stof (2020). DOI:10.1016/j.matt.2020.01.024 Et team ved University of Glasgow har udviklet en ny måde at generere tilfældige tal ved at bruge tilfældigheden i krystalvækst. I deres papir -
 Opfinder verdens stærkeste sølvInde i et sølvkorn, kobberatomurenheder (i grønt) er blevet selektivt adskilt til en korngrænse (til venstre) og til indre defekter (lange strenge, streamer nedad.) Dette øjebliksbillede, fra en atomi
Opfinder verdens stærkeste sølvInde i et sølvkorn, kobberatomurenheder (i grønt) er blevet selektivt adskilt til en korngrænse (til venstre) og til indre defekter (lange strenge, streamer nedad.) Dette øjebliksbillede, fra en atomi -
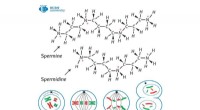 Biokemiker opdager et lovende enzym til at bekæmpe kræftcellerKredit:RUDN Universitet En biokemiker fra RUDN Universitet har undersøgt kemiske stoffers stimulerende virkning på det kataboliske enzym PAO (polyaminoxidase). Resultaterne kan bidrage til udvikli
Biokemiker opdager et lovende enzym til at bekæmpe kræftcellerKredit:RUDN Universitet En biokemiker fra RUDN Universitet har undersøgt kemiske stoffers stimulerende virkning på det kataboliske enzym PAO (polyaminoxidase). Resultaterne kan bidrage til udvikli -
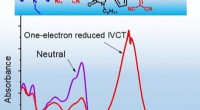 Tændt for IR-aktive organiske pigmenterKredit:Wiley I fotosyntese og organisk solcelle, pigmentmolekyler omdanner lys til elektrisk ladning. Et team af kemikere har nu produceret et usædvanligt organisk pigment, som tændes af en elektr
Tændt for IR-aktive organiske pigmenterKredit:Wiley I fotosyntese og organisk solcelle, pigmentmolekyler omdanner lys til elektrisk ladning. Et team af kemikere har nu produceret et usædvanligt organisk pigment, som tændes af en elektr
- Hvad er den cirkel, der 23,5 grader nord for ækvator?
- Fysikere skaber nye nanopartikler til kræftbehandling
- Afklaring af komplekse kemiske processer med kvantecomputere
- Sådan foretages metrisk konvertering Easy
- Elefanter bruger fagter og stemmesignaler, når de hilser på hinanden, rapporterer undersøgelsen
- Forskning viser, at børn har stærke meninger om, hvad forældre lægger dem op på nettet


