Hvor mange valenselektroner har Cooper?
Her er hvorfor:
* Elektronkonfiguration: Kobberens elektronkonfiguration er [AR] 3D¹⁰ 4S¹.
* Valenselektroner: Valenselektroner er elektronerne i det yderste energiniveau. I Copper's tilfælde er det yderste energiniveau det 4. niveau, og det har et elektron i 4S -orbitalen.
Vigtig note: Mens kobber har et fuldt 3D -underskal, har det kun en valenselektron. 3D -elektronerne er involveret i binding, men de betragtes som kerneelektroner, ikke valenselektroner.
Sidste artikelEr en sprød sammensat molekylær forbindelse?
Næste artikelHvad er noget interessant ved titanium?
 Varme artikler
Varme artikler
-
 Forskning baner vej for næste generation af screeningsenheder for krystallinsk materialeEn illustration af den kontinuerlige mikrofluidiske enhed til hurtig screening af krystaller af aktive farmaceutiske ingredienser. Når krystaller vokser, automatiseret dataindsamling og parallel behan
Forskning baner vej for næste generation af screeningsenheder for krystallinsk materialeEn illustration af den kontinuerlige mikrofluidiske enhed til hurtig screening af krystaller af aktive farmaceutiske ingredienser. Når krystaller vokser, automatiseret dataindsamling og parallel behan -
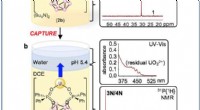 Team udvikler en elektrokemisk metode til udvinding af uran, og potentielt andre metalioner, fra lø…En illustration af den elektrokemiske koblingsmetode til at fange og frigive uranioner. Kredit:University of California - Santa Barbara For 50 år siden, videnskabsmænd ramte på, hvad de troede kun
Team udvikler en elektrokemisk metode til udvinding af uran, og potentielt andre metalioner, fra lø…En illustration af den elektrokemiske koblingsmetode til at fange og frigive uranioner. Kredit:University of California - Santa Barbara For 50 år siden, videnskabsmænd ramte på, hvad de troede kun -
 Brygget kaffegrums tilbyder et bæredygtigt alternativ til farvestof til tøjKredit:Iowa State University Forskere fra Iowa State University har fundet en naturlig måde at tilføje farve til tøjet ved at bruge resterne fra din daglige kop kaffe. Tekstilindustrien bruger me
Brygget kaffegrums tilbyder et bæredygtigt alternativ til farvestof til tøjKredit:Iowa State University Forskere fra Iowa State University har fundet en naturlig måde at tilføje farve til tøjet ved at bruge resterne fra din daglige kop kaffe. Tekstilindustrien bruger me -
 Udvideligt skum til 3D-udskrivning af store objekterKredit:CC0 Public Domain Det er en frustrerende begrænsning ved 3D-print:Udskrevne objekter skal være mindre end den maskine, der fremstiller dem. Kæmpe maskiner er upraktiske til at printe store
Udvideligt skum til 3D-udskrivning af store objekterKredit:CC0 Public Domain Det er en frustrerende begrænsning ved 3D-print:Udskrevne objekter skal være mindre end den maskine, der fremstiller dem. Kæmpe maskiner er upraktiske til at printe store
- Hurtigt radioudbrud lokaliseret til en fjern galakse
- Hvad skete der i rummet den 16. juni 1963?
- Er salt eller sukker opløst i vand en fysisk ændring?
- Ammoniak fra landbruget påvirker skydannelsen over Asien
- Ledetråde fra tidligere vulkansk eksplosion hjælper teamet med at modellere fremtidig aktivitet
- Forsinket langsom havreaktion på kuldioxidfjernelse forårsager asymmetrisk ændring i tropisk nedb…


