Hvad sker der er, at du tilføjer yderligere solid NaCl, efter at den maksimale opløselighed er nået?
* ikke mere NaCl vil opløses: Løsningen er allerede mættet, hvilket betyder, at den har den maksimale mængde opløst NaCl ved den temperatur.
* Overskydende NaCl forbliver uopløst: Den tilsatte NaCl vil simpelthen slå sig ned i bunden af beholderen som et fast bundfald.
* Koncentrationen af opløsningen forbliver konstant: Selvom du tilføjer mere solid, bliver løsningen ikke mere koncentreret, fordi den overskydende NaCl ikke opløses.
Tænk på det som en svamp: En mættet opløsning er som en fuld svamp - den kan ikke absorbere mere vand. At tilføje mere vand til en fuld svamp gør det ikke vådere; Det sidder bare på toppen.
Faktorer, der påvirker opløselighed:
Husk, at opløselighed er påvirket af flere faktorer:
* Temperatur: Opløseligheden af de fleste faste stoffer øges med temperaturen.
* tryk: For gasser øges opløseligheden med tryk.
* Polaritet: Lignende stoffer opløses i hinanden (f.eks. Polære opløste stoffer opløses i polære opløsningsmidler).
Så mens løsningen forbliver mættet, kan du potentielt øge opløseligheden af NaCl af:
* Forøgelse af temperaturen: Dette giver flere NaCl mulighed for at opløses.
* Tilføjelse af et andet opløsningsmiddel: Nogle opløsningsmidler kan have en højere kapacitet til at opløse NaCl end vand.
Fortæl mig, hvis du har flere spørgsmål!
 Varme artikler
Varme artikler
-
 Potentialet for ikke-giftige materialer til at erstatte bly i perovskit-solcellerDet er stadig en udfordring at udskifte bly med mindre giftige materialer i perovskit -solceller uden at gå på kompromis med ydeevnen. Kredit:Tsinghua University og LeadVanced PV Co., Ltd At udvik
Potentialet for ikke-giftige materialer til at erstatte bly i perovskit-solcellerDet er stadig en udfordring at udskifte bly med mindre giftige materialer i perovskit -solceller uden at gå på kompromis med ydeevnen. Kredit:Tsinghua University og LeadVanced PV Co., Ltd At udvik -
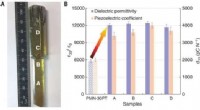 Forskere finder, at tilføjelse af sjældne jordarters element til piezoelektriske krystaller forbed…Billede og elektromekaniske egenskaber af [001]-orienterede Sm-doterede PMN-PT-krystaller. (A) Billede af Sm-PMN-PT-krystal som vokset. Sammensætningen af punkt A, B, C, og D er anført i tabel S1. (
Forskere finder, at tilføjelse af sjældne jordarters element til piezoelektriske krystaller forbed…Billede og elektromekaniske egenskaber af [001]-orienterede Sm-doterede PMN-PT-krystaller. (A) Billede af Sm-PMN-PT-krystal som vokset. Sammensætningen af punkt A, B, C, og D er anført i tabel S1. ( -
 Materialer, der åbner i øjeblikkets varmeSommerfuglformede ligander var nøglen til at designe et materiale, der selektivt kan absorbere og lagre forskellige gasmolekyler. Kredit:Izumi Mindy Takamiya Kyoto-universitetets forskere har desi
Materialer, der åbner i øjeblikkets varmeSommerfuglformede ligander var nøglen til at designe et materiale, der selektivt kan absorbere og lagre forskellige gasmolekyler. Kredit:Izumi Mindy Takamiya Kyoto-universitetets forskere har desi -
 U i Minnesota får tilskud til at udvikle bedre majsbaseret plastKredit:CC0 Public Domain Kornbønder i Minnesota investerer i forskning ved University of Minnesota med det formål at udvikle en mere nyttig majsbaseret plast. Minnesota Corn Growers Association a
U i Minnesota får tilskud til at udvikle bedre majsbaseret plastKredit:CC0 Public Domain Kornbønder i Minnesota investerer i forskning ved University of Minnesota med det formål at udvikle en mere nyttig majsbaseret plast. Minnesota Corn Growers Association a
- I krigsramte Gaza, vandforurening bag sundhedsproblemer
- Streaming-tv-tjenester:Hvad de koster, hvad du får
- Hvad trækker i spænding?
- IBM køber softwarevirksomheden Red Hat for 34 milliarder dollars i bud på cloud-dominans
- Hvad er observationer foretaget med værktøjer, der kaldes?
- Ny bog blandt de første til at undersøge, hvordan mennesker med handicap kan tage juridiske, beslu…


