Hvor mange elektroner får halogenatomer, når de reagerer?
Her er hvorfor:
* Elektronkonfiguration: Halogener er placeret i gruppe 17 (VIIA) i den periodiske tabel. De har 7 valenselektroner (elektroner i den yderste skal).
* octet regel: Atomer har en tendens til at vinde, miste eller dele elektroner for at opnå en stabil elektronkonfiguration med 8 valenselektroner (Octet -regel).
* reaktivitet: For at opnå en oktet får halogener let en elektron. Dette gør dem meget reaktive og tilbøjelige til at danne negative ioner kaldet halogenider.
Eksempel: Chlor (CL) har 7 valenselektroner. Når det får en elektron, bliver det en chloridion (CL-) med en fuld oktet på 8 elektroner.
Nøglepunkt: Tendensen til at få et elektron er det definerende træk ved halogener som ikke -metaller.
 Varme artikler
Varme artikler
-
 Prions:Nyt muligt terapeutisk mål opdagetprioner. Kredit:National Institute of Health Prionsygdomme, såsom bovin spongiform encephalopati (kogalskab), er dødelige neurodegenerative infektionssygdomme, som påvirker mennesker og andre patte
Prions:Nyt muligt terapeutisk mål opdagetprioner. Kredit:National Institute of Health Prionsygdomme, såsom bovin spongiform encephalopati (kogalskab), er dødelige neurodegenerative infektionssygdomme, som påvirker mennesker og andre patte -
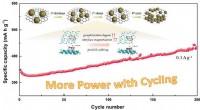 Partikelforfining inducerer og øger cykluskapaciteten af natrium/lithium-ion-batterierSkematisk diagram af mekanismen for partikelforfining for at inducere forøgelse af cykluskapaciteten af SIBer. Kredit:WANG Canpei Natriumionbatterier (SIBer) har tiltrukket bred opmærksomhed på
Partikelforfining inducerer og øger cykluskapaciteten af natrium/lithium-ion-batterierSkematisk diagram af mekanismen for partikelforfining for at inducere forøgelse af cykluskapaciteten af SIBer. Kredit:WANG Canpei Natriumionbatterier (SIBer) har tiltrukket bred opmærksomhed på -
 Forskere syntetiserer gipserstatningNaturlig gipssten. Kredit:Maksim Safaniuk Et internationalt hold af videnskabsmænd har foreslået en metode til fremstilling af højkvalitets gipsbindemidler baseret på syntetisk calciumsulfatdihydr
Forskere syntetiserer gipserstatningNaturlig gipssten. Kredit:Maksim Safaniuk Et internationalt hold af videnskabsmænd har foreslået en metode til fremstilling af højkvalitets gipsbindemidler baseret på syntetisk calciumsulfatdihydr -
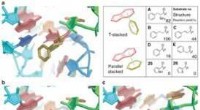 Hærprojekt kan føre til en ny klasse af højtydende materialerSyntetiske biologer, der arbejder på et amerikansk hærsprojekt, har udviklet et sæt designregler, der guider hvordan ribosomer, en cellestruktur, der danner protein, kunne føre til en ny klasse af syn
Hærprojekt kan føre til en ny klasse af højtydende materialerSyntetiske biologer, der arbejder på et amerikansk hærsprojekt, har udviklet et sæt designregler, der guider hvordan ribosomer, en cellestruktur, der danner protein, kunne føre til en ny klasse af syn
- Er acetylsalicylsyre en ionbinding?
- Denne måde, det-væk:Forskere giver hunden en speciel vest med lys for at fortælle den, hvor den s…
- Cambridge Analytica-skandale - legitime forskere, der bruger Facebook-data, kan være sideløbende s…
- Hubble-rumteleskopet fanger sommertiden på Saturn
- Forskere efterligner kometmøl silkefibre for at lave stof med aircondition
- Sådan beregnes grundvandshastighed


