Hvad er forekomsten af en isotop atommasse 64.9278?
* isotoper har det samme antal protoner, men forskellige antal neutroner. Dette betyder, at atommassen kan være en anelse om isotopens identitet, men det er ikke nok.
* overflod henviser til den relative procentdel af en isotop i en naturligt forekommende prøve. For at bestemme dette skal du vide:
* elementet: Hvilket element hører denne isotop til? (f.eks. Kobber, zink osv.)
* Andre isotoper af dette element: Elementer har ofte flere isotoper. Du skal kende atommasserne af disse andre isotoper og deres relative forekomster.
Eksempel:
Lad os sige, at du leder efter forekomsten af isotopen med masse 64.9278 i kobber (CU) . Her er hvad du skal gøre:
1. Identificer isotoperne af kobber: Kobber har to hovedisotoper:Cu-63 og Cu-65.
2. Find deres atommasser: Cu-63 har en masse på 62.9296 AMU, og Cu-65 har en masse på 64.9278 amu.
3. Bestem deres relative forekomster: Overfloden af Cu-63 er ca. 69,17%, og forekomsten af Cu-65 er ca. 30,83%.
Derfor er forekomsten af isotopen med atommasse 64.9278 (CU-65) ca. 30,83%.
Angiv elementet eller andre oplysninger for at bestemme forekomsten af isotopen med atommasse 64.9278.
Sidste artikelHvad kalder du et hydrat, når det har mistet sine vand -moecules?
Næste artikelHvad er den flydende matrix af blod?
 Varme artikler
Varme artikler
-
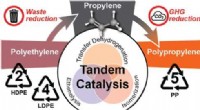 Forskere finder ud af at genbruge plast for at reducere drivhusgasemissionerneGrafisk abstrakt. Kredit:Journal of the American Chemical Society (2022). DOI:10.1021/jacs.2c07781 Forskere fra University of Illinois Urbana-Champaign, University of California, Santa Barbara og D
Forskere finder ud af at genbruge plast for at reducere drivhusgasemissionerneGrafisk abstrakt. Kredit:Journal of the American Chemical Society (2022). DOI:10.1021/jacs.2c07781 Forskere fra University of Illinois Urbana-Champaign, University of California, Santa Barbara og D -
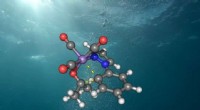 Det nye grønne alternativ til medicinproduktionStruktur af den aktive mangankatalysator i vand. Kredit:Universitetet i Göttingen De fleste af processerne til fremstilling af lægemidler, pesticider og smartphone-skærme er omkostningstunge og ge
Det nye grønne alternativ til medicinproduktionStruktur af den aktive mangankatalysator i vand. Kredit:Universitetet i Göttingen De fleste af processerne til fremstilling af lægemidler, pesticider og smartphone-skærme er omkostningstunge og ge -
 Kemiske ingeniører replikerer foder, kamp og flugt-reaktioner i katalytiske kemiske reaktionerOverfladearealet af aktive steder på den røde krabbe er dobbelt så stort som på den grønne grab; derfor, den røde krabbe trækker partikler væk fra grønne konkurrenter ved at generere stærkere indadgåe
Kemiske ingeniører replikerer foder, kamp og flugt-reaktioner i katalytiske kemiske reaktionerOverfladearealet af aktive steder på den røde krabbe er dobbelt så stort som på den grønne grab; derfor, den røde krabbe trækker partikler væk fra grønne konkurrenter ved at generere stærkere indadgåe -
 Manipulering af jordrige materialer for at udnytte solens energiBevægelse af elektroner blandt atomerne i et materiale (benævnt ledningsevne) er afgørende for mange af materialets egenskaber. I denne forskning, videnskabsmænd fandt forskellige ledningsevner i magn
Manipulering af jordrige materialer for at udnytte solens energiBevægelse af elektroner blandt atomerne i et materiale (benævnt ledningsevne) er afgørende for mange af materialets egenskaber. I denne forskning, videnskabsmænd fandt forskellige ledningsevner i magn
- Hvad udsender infrarødt lys?
- Forskere udvikler en intervention, der reducerer recidiv blandt børn, der kommer tilbage i skole, f…
- Orkanen Ian forventes at oversvømme Florida efter at have forladt Cuba uden strøm
- At komme ind på arbejdsmarkedet i en recession kan tage år af dit liv, undersøgelse finder
- Ny Angry Birds tv-serie udklækkes
- Hvad er konsolideringskoefficient?


