Forekommer nogen metalliske elementer normalt som gasser?
Her er hvorfor:
* Metallisk binding: Metaller er kendetegnet ved stærke metalliske bindinger. Disse bindinger involverer et "hav" af delokaliserede elektroner, der deles mellem alle metalatomer. Denne stærke binding resulterer i et meget højt smeltepunkt og kogepunkt for de fleste metaller.
* Stater af stof: Metaller findes typisk som faste stoffer ved stuetemperatur. For at blive en gas er de nødt til at overvinde disse stærke metalliske bindinger, hvilket kræver en betydelig mængde energi.
Undtagelser:
Selvom det er sandt, at de fleste metaller er faste stoffer, er der nogle få undtagelser:
* Merkur (Hg): Kviksølv er det eneste metal, der er flydende ved stuetemperatur. Det har et relativt lavt kogepunkt på 356,73 ° C (674,11 ° F), så det kan blive en gas ved højere temperaturer.
* cesium (CS) og Francium (FR): Disse elementer er også flydende ved stuetemperatur og har meget lave kogepunkter, hvilket betyder, at de let kan fordampe. De er imidlertid ekstremt reaktive og findes ikke naturligt i deres elementære form.
Selvom det er sandt, at metaller kan eksistere i gasformige tilstande under ekstremt høje temperaturer, forekommer de normalt ikke som gasser under standardbetingelser.
Sidste artikelHvilken type strøm bruges i elektrolyse?
Næste artikelHvad er hydrolysen af disaccharider?
 Varme artikler
Varme artikler
-
 Forsker arbejder på at forstå, hvordan gonoré udvikler resistens over for antibiotikaDette billede genereret ved røntgenkrystallografi viser et cephalosporin-antibiotikum, i pink, binding til et protein fra bakterien, der forårsager gonoré. Kuglerne repræsenterer vandmolekyler. Kredit
Forsker arbejder på at forstå, hvordan gonoré udvikler resistens over for antibiotikaDette billede genereret ved røntgenkrystallografi viser et cephalosporin-antibiotikum, i pink, binding til et protein fra bakterien, der forårsager gonoré. Kuglerne repræsenterer vandmolekyler. Kredit -
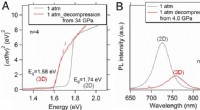 Trykinduceret 2D-3D konvertering i hybrid blyiodid lagdelt perovskit2D-3D overgang i hybrid perovskites. Kredit:Gang Liu Hydrostatisk tryk kan føre til nye og forbedrede materialeegenskaber. Imidlertid, de fleste nye materialeegenskaber kan kun bevares ved højtryk
Trykinduceret 2D-3D konvertering i hybrid blyiodid lagdelt perovskit2D-3D overgang i hybrid perovskites. Kredit:Gang Liu Hydrostatisk tryk kan føre til nye og forbedrede materialeegenskaber. Imidlertid, de fleste nye materialeegenskaber kan kun bevares ved højtryk -
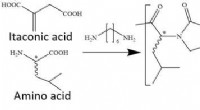 Pepsin-nedbrydelig plast af bio-nyloner fra itaconsyre og aminosyrerFigur 1. Udviklingsstrategi for pepsinnedbrydelige BioNyloner fra itaconsyre og leucin. Kredit:Tatsuo Kaneko og Mohammad Asif Ali fra JAIST Aktuelt tilgængeligt konventionelt nylon såsom nylon 6,
Pepsin-nedbrydelig plast af bio-nyloner fra itaconsyre og aminosyrerFigur 1. Udviklingsstrategi for pepsinnedbrydelige BioNyloner fra itaconsyre og leucin. Kredit:Tatsuo Kaneko og Mohammad Asif Ali fra JAIST Aktuelt tilgængeligt konventionelt nylon såsom nylon 6, -
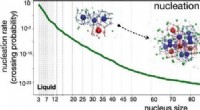 Hastighedsforudsigelse for homogen kernedannelse af methanhydratKredit:HIMS Metanhydrater er den største enkeltkilde til fossilt brændstof på planeten jorden og spiller en rolle i klimaændringer. Den molekylære proces af deres dannelse er ikke kendt og stærkt
Hastighedsforudsigelse for homogen kernedannelse af methanhydratKredit:HIMS Metanhydrater er den største enkeltkilde til fossilt brændstof på planeten jorden og spiller en rolle i klimaændringer. Den molekylære proces af deres dannelse er ikke kendt og stærkt
- USA dropper droneteknologi for at øge våbensalget
- Britiske fodboldfans afviser at tage knæet som en hul gestus, der ikke bekæmper racisme
- Hvordan kan ilt fremstilles på en ny planet?
- Forskere udvikler guldkompleksbundne ferrocenylphosphiner som potente malariamidler
- Oxygenmolekyler kommer ind i en celle ved diffusion, som er?
- Mikromotorer drives af bakterier, styret af lys


