Hvad sker der, når du blander salt og destilleret vand?
1. Opløsning:
* Salt opløses i vand. Dette betyder de ioniske bindinger, der holder natrium (Na+) og chlorid (Cl-) ioner sammen i saltkrystallpausen.
* Vandmolekylerne omgiver ionerne, trækker dem fra hinanden og ind i opløsningen. Denne proces kaldes hydrering.
2. Dannelse af en elektrolytopløsning:
* De opløste ioner, Na+ og Cl-, bliver fri til at bevæge sig rundt i vandet.
* Dette gør løsningen til elektrolyt , hvilket betyder, at det kan udføre elektricitet. Dette skyldes, at de ladede ioner kan bære en elektrisk strøm.
3. Ændring i egenskaber:
* Løsningen har nu et højere kogepunkt og et lavere frysepunkt end rent vand.
* Løsningen af opløsningen øges også sammenlignet med rent vand.
4. Ingen kemisk reaktion:
* Det er vigtigt, at blanding af salt og vand ikke resulterer i en kemisk reaktion . Salt opløses simpelthen og bryder ned i dets bestanddele.
Kortfattet: Blanding af salt og destilleret vand resulterer i en homogen opløsning, hvor saltet opløses, hvilket danner en elektrolytopløsning med ændrede fysiske egenskaber.
Sidste artikelHvorfor udviser lanthanider lignende kemisk adfærd?
Næste artikelHvad er konsekvenserne af uran?
 Varme artikler
Varme artikler
-
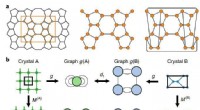 En ny matematisk tilgang til forståelse af zeolitterGraph og supercell matching. en, Repræsentation af en zeolit ved hjælp af en graf (til venstre). Enhedscellegrafen (midten) modificeres for at opfylde periodiske grænsebetingelser ved at sløjfe bind
En ny matematisk tilgang til forståelse af zeolitterGraph og supercell matching. en, Repræsentation af en zeolit ved hjælp af en graf (til venstre). Enhedscellegrafen (midten) modificeres for at opfylde periodiske grænsebetingelser ved at sløjfe bind -
 Håndholdte DNA-sekventører viser løfte om overvågning af mikrober under fødevareproduktionKredit:CC0 Public Domain Håndholdte enheder er velegnede til miljøovervågning under fødevareproduktion, og har nøglefordele med hensyn til brugervenlighed og ved at identificere en bred vifte af b
Håndholdte DNA-sekventører viser løfte om overvågning af mikrober under fødevareproduktionKredit:CC0 Public Domain Håndholdte enheder er velegnede til miljøovervågning under fødevareproduktion, og har nøglefordele med hensyn til brugervenlighed og ved at identificere en bred vifte af b -
 Selvvandende jord kan ændre landbrugetForskere plantede radiser i dette miniaturedrivhus ved hjælp af deres selvvandende jord og sammenlignede det med sandjord, der findes i tørre områder af verden. Kredit:University of Texas i Austin
Selvvandende jord kan ændre landbrugetForskere plantede radiser i dette miniaturedrivhus ved hjælp af deres selvvandende jord og sammenlignede det med sandjord, der findes i tørre områder af verden. Kredit:University of Texas i Austin -
 Brintkraft rykker et skridt nærmereFossile brændstoffer tegnede sig for næsten 90 procent af energiforbruget i 2015. Kredit:Lancaster University Fysikere ved Lancaster University udvikler metoder til at skabe vedvarende brændstof f
Brintkraft rykker et skridt nærmereFossile brændstoffer tegnede sig for næsten 90 procent af energiforbruget i 2015. Kredit:Lancaster University Fysikere ved Lancaster University udvikler metoder til at skabe vedvarende brændstof f
- Verdens kornproduktion gik mod rekord i 2017:FAO
- Ny 3-D bioprintingsplatform til mikroplader til konstruktion af muskel- og senevæv
- Ny forudsigelsesmodel for vendepunkter giver indsigt i faldende bi -kolonier
- Alternative græsplæner viser potentiale til brug på golfbaners fairways
- Er ioner til stede i rent flydende HCl?
- Behandlet spildevand i Victoria er stadig forurenet, viser undersøgelsen. Så er mennesker og miljø…


