Hvorfor udviser lanthanider lignende kemisk adfærd?
1. Lignende elektroniske konfigurationer:
* Alle lanthanider har den samme ydre elektroniske konfiguration af [xe] 4f n 5d 0-1 6s 2 , hvor 'n' varierer fra 1 til 14, svarende til påfyldningen af 4F -orbitaler.
* 4F -elektronerne er afskærmet af de fyldte 5s og 5p orbitaler, hvilket gør dem mindre involveret i kemisk binding.
* Derfor bestemmes de kemiske egenskaber af lanthanider stort set af inddragelsen af 6S -elektronerne.
2. Sammentrækning af Lanthanide -serien:
* Når du bevæger dig over Lanthanide -serien, øges atomafgiften, men afskærmningseffekten forbliver stort set konstant på grund af den dårlige afskærmningsevne på 4F -elektroner.
* Dette fører til et gradvis fald i den ioniske radius af lanthanider, kendt som lanthanid -sammentrækningen.
* Denne sammentrækning, selv om den er lille, påvirker styrken af den elektrostatiske tiltrækning mellem lanthanidion og ligander.
3. Overvejende +3 oxidationstilstand:
* Lanthanides har en tendens til at have en +3 oxidationstilstand på grund af tabet af de to 6S -elektroner og en 4F -elektron.
* Denne konsistente oxidationstilstand bidrager til deres lignende reaktivitet.
4. Lignende ioniske radier:
* På grund af lanthanid -sammentrækning er de ioniske radier af tilstødende lanthanider meget ens.
* Denne lighed i ionisk størrelse giver dem mulighed for at danne lignende forbindelser og udvise lignende koordinationsnumre.
5. Høj koordinationsnumre:
* Lanthanider danner typisk koordinationskomplekser med høje koordinationsnumre (f.eks. 8, 9, 10).
* Dette skyldes deres store størrelse og tilgængelighed af ledige orbitaler i de ydre skaller.
6. Begrænset deltagelse af 4f orbitaler i binding:
* 4F -orbitaler er relativt begravet i elektronskyen og deltager minimalt i kemisk binding.
* Derfor påvirker variationen i antallet af 4F -elektroner ikke den samlede kemiske opførsel.
Kortfattet:
De lignende elektroniske konfigurationer, lanthanid -sammentrækningen og den overvejende +3 oxidationstilstand bidrager til den lignende kemiske opførsel af lanthanider. Deres lignende ioniske radier og tendens til at danne høje koordinationskomplekser med minimal involvering af 4F -orbitaler i binding yderligere forstærker deres delte kemiske egenskaber.
Sidste artikelEn radioaktiv isotop er det?
Næste artikelHvad sker der, når du blander salt og destilleret vand?
 Varme artikler
Varme artikler
-
 Maskinlæringsassisteret molekylært design til højtydende organiske fotovoltaiske materialerBrug af maskinlæring til at hjælpe molekylært design. Kredit:Wenbo Sun, Videnskabens fremskridt, doi:10.1126/sciadv.aay4275 At syntetisere højtydende materialer til organisk fotovoltaik (OPVer), d
Maskinlæringsassisteret molekylært design til højtydende organiske fotovoltaiske materialerBrug af maskinlæring til at hjælpe molekylært design. Kredit:Wenbo Sun, Videnskabens fremskridt, doi:10.1126/sciadv.aay4275 At syntetisere højtydende materialer til organisk fotovoltaik (OPVer), d -
 Bibliotek af edderkoppesilke kunne rumme hemmeligheder for nye materialerSølvhaveedderkopper (Argiope argentata) sidder i deres spind i Cheryl Hayashis laboratorium på American Museum of Natural History i New York. Edderkoppesilker starter alle på samme måde:en klud goo, b
Bibliotek af edderkoppesilke kunne rumme hemmeligheder for nye materialerSølvhaveedderkopper (Argiope argentata) sidder i deres spind i Cheryl Hayashis laboratorium på American Museum of Natural History i New York. Edderkoppesilker starter alle på samme måde:en klud goo, b -
 Kemikere programmerer flydende krystallinske elastomerer til at replikere komplekse vridningsvirknin…En simuleret LCE-mikropost med den nematiske direktør orienteret i 45 grader i forhold til den flade overflade. Belysning af den ene side af stolpen får toppen af stolpen til at vride sig i forhold
Kemikere programmerer flydende krystallinske elastomerer til at replikere komplekse vridningsvirknin…En simuleret LCE-mikropost med den nematiske direktør orienteret i 45 grader i forhold til den flade overflade. Belysning af den ene side af stolpen får toppen af stolpen til at vride sig i forhold -
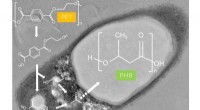 Hvordan en bakterie kan hjælpe med at løse plastikforureningskrisenI. sakaiensis dyrket på poly (ethylenterephthalat) (PET) akkumulerer poly (3-hydroxybutyrat) (PHB). Kredit:Shosuke Yoshida Plastforurening er et af de mest presserende miljøspørgsmål i vores tid.
Hvordan en bakterie kan hjælpe med at løse plastikforureningskrisenI. sakaiensis dyrket på poly (ethylenterephthalat) (PET) akkumulerer poly (3-hydroxybutyrat) (PHB). Kredit:Shosuke Yoshida Plastforurening er et af de mest presserende miljøspørgsmål i vores tid.
- Ny selfie viser Curiosity, Mars-kemikeren
- Hvad er udtrykket for en samlet mængde udskiftelig luft?
- Når en krystal i ubegrænset rum, hvordan opstår vækst?
- Ingeniører producerer langvarig, energitæthed batteri
- Hvorfor går havskorpen under kontinentalt, når de støder sammen?
- Hvordan kunstig intelligens kan finde kilden til gammastråleudbrud


