Hvorfor når et stof koger, forbliver det ved 100c?
Forholdet mellem varmeenergi og faseændringer
* Varme og temperatur: Når du tilsætter varme til et stof, begynder molekylerne i dette stof at bevæge sig hurtigere. Denne øgede bevægelse betyder en højere temperatur.
* Faseændringer: Ved en bestemt temperatur bruges den tilsatte varmeenergi ikke længere til at øge temperaturen, men går i stedet mod at bryde bindingerne mellem molekyler. Dette er punktet med en faseændring, ligesom fra væske til gas (kogning).
kogning forklaret
1. Tilføjelse af varme: Når du opvarmer vand, får molekylerne kinetisk energi og bevæger sig hurtigere.
2. når kogepunktet: Når vandet når 100 ° C, har det nok energi til, at nogle molekyler kan overvinde kræfterne, der holder dem sammen som en væske. Disse molekyler slipper ud i luften som damp.
3. Konstant temperatur: Den tilsatte varmeenergi bruges nu til at bryde flere bindinger og omdanne mere flydende vand til damp, ikke til at hæve temperaturen. Dette betyder, at vandet forbliver ved 100 ° C.
4. kogning fortsætter: Så længe du fortsætter med at tilføje varme, fortsætter processen, og vandet koger.
Hvorfor forbliver det konstant (faseændring vs. temperaturændring)
* Breaking Bonds: Den energi, du tilføjer, øger ikke molekylernes hastighed (hvilket ville øge temperaturen). I stedet går det mod at bryde bindingerne mellem vandmolekylerne, så de kan flygte som damp.
* ligevægt: Mens nogle molekyler slipper ud, kondenseres andre stadig tilbage i den flydende tilstand. Dette skaber en balance og holder temperaturen konstant.
Vigtig note: Denne forklaring er for standard atmosfærisk tryk. Kogepunktet for et stof kan ændres ved forskellige tryk. For eksempel koger vand ved en lavere temperatur i højere højder.
Sidste artikelHvad er nødvendigt for nitrogen at kombinere med ilt?
Næste artikelHvad er fysiske egenskaber ved essentiel olie?
 Varme artikler
Varme artikler
-
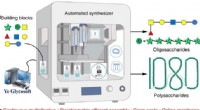 Automatisk kulhydratsynthesizer producerer polysaccharider af rekordlængdeGrafisk abstrakt. Kredit:Nature Synthesis (2022). DOI:10.1038/s44160-022-00171-9 Et team af forskere med medlemmer fra Peking University og WuXi AppTec (Tianjin) Co., Ltd., har designet og bygget e
Automatisk kulhydratsynthesizer producerer polysaccharider af rekordlængdeGrafisk abstrakt. Kredit:Nature Synthesis (2022). DOI:10.1038/s44160-022-00171-9 Et team af forskere med medlemmer fra Peking University og WuXi AppTec (Tianjin) Co., Ltd., har designet og bygget e -
 Metamaterialer tilbyder multifunktionelle materialer til teknikMetamaterialet til venstre tilbyder flere funktioner ved at ændre dets deformation. Ved at komprimere det langsomt (nederst til højre) eller hurtigt (øverst til højre), vi kan ændre, om metamaterialet
Metamaterialer tilbyder multifunktionelle materialer til teknikMetamaterialet til venstre tilbyder flere funktioner ved at ændre dets deformation. Ved at komprimere det langsomt (nederst til højre) eller hurtigt (øverst til højre), vi kan ændre, om metamaterialet -
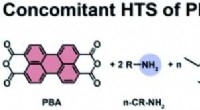 Teamet bruger varmt vand til at danne fotokatalysatorSyntese af n-alkyl-PBI i nærvær af TEOS (n =1, 5, 10 og 100 ækv.). R =n-propylamin (C3), n-pentylamin (C5), n-octylamin (C8), n-tetradecylamin (C14). Kredit:Hipassia M. Moura et al., Journal of Materi
Teamet bruger varmt vand til at danne fotokatalysatorSyntese af n-alkyl-PBI i nærvær af TEOS (n =1, 5, 10 og 100 ækv.). R =n-propylamin (C3), n-pentylamin (C5), n-octylamin (C8), n-tetradecylamin (C14). Kredit:Hipassia M. Moura et al., Journal of Materi -
 Video:Frihedsgudindens sande farverKredit:The American Chemical Society Frihedsgudinden er et ikonisk blågrønt symbol på frihed. Men vidste du, at hun ikke altid var den farve? Da Frankrig gav Lady Liberty til USA, hun var en 305
Video:Frihedsgudindens sande farverKredit:The American Chemical Society Frihedsgudinden er et ikonisk blågrønt symbol på frihed. Men vidste du, at hun ikke altid var den farve? Da Frankrig gav Lady Liberty til USA, hun var en 305
- Er vand ikke levende eller lever?
- Gammel naturlig fissionsreaktor giver fingerpeg om, hvordan man opbevarer moderne nukleart affald
- Hvordan supercomputere hjælper os med at koble kvanteindvikling til kold kaffe
- Hvorfor er aktiveringsenergien for organiske reaktioner høj?
- Bourgogne vindruer fortæller klimahistorie, viser, at opvarmningen er accelereret i de sidste 30 å…
- Hvad er en sætning med drivhuseffekt?


