Hvad er nødvendigt for nitrogen at kombinere med ilt?
1. Input med høj energi: Bindingen mellem nitrogenatomer i N2 er meget stærk, hvilket kræver en betydelig mængde energi for at bryde det. Dette kan opnås gennem:
* Høje temperaturer: Dette er grunden til, at lynnedslag, forbrænding og høje temperaturprocesser som dem, der findes i bilmotorer, kan føre til, at der dannes nitrogenoxider.
* katalysatorer: Nogle metaller som platin kan fungere som katalysatorer og sænke den aktiveringsenergi, der er nødvendig for, at reaktionen kan forekomme.
2. Passende betingelser: Mens input med høj energi er nødvendig, er det ikke nok. Reaktionen har også brug for:
* tilstedeværelse af ilt: Dette synes åbenlyst, men du har brug for en passende forsyning med ilt til nitrogenet at kombinere med.
* Korrekt tryk: Reaktionen favoriserer ofte højere tryk, hvilket hjælper med at drive reaktionen mod dannelsen af nitrogenoxider.
3. Specifikke kemiske reaktioner: Der er forskellige måder, nitrogen og ilt kan kombinere, hver med sine egne specifikke betingelser. For eksempel:
* forbrænding: Brændende brændstoffer i nærvær af luft kan føre til dannelse af nitrogenoxider (NOX), primært nitrogenmonoxid (NO).
* Lyn: Lyntrejker giver nok energi til at bryde N2 -bindingen og føre til dannelse af nitrogenoxider, herunder nitrogendioxid (NO2).
* Industrielle processer: Nogle industrielle processer, som Haber-Bosch-processen til ammoniaksyntese, bruger høje temperaturer og tryk til at bryde N2-bindingen og danne nitrogenholdige forbindelser.
Kortfattet: For at få nitrogen til at kombinere med ilt, skal du tilvejebringe en betydelig mængde energi, typisk i form af høje temperaturer eller katalysatorer, og de korrekte betingelser som ilttilstedeværelse og passende tryk. Disse tilstande findes i forskellige naturlige og industrielle processer, hvilket fører til dannelse af forskellige nitrogenoxider.
Sidste artikelHvad er den mest almindelige ion af neon?
Næste artikelHvorfor når et stof koger, forbliver det ved 100c?
 Varme artikler
Varme artikler
-
 Sammenføjning af xenongas ud af affaldsstrømmeMetal organiske rammer, med nanoporer og høj affinitet for xenon, kan adskille gassen fra luft eller affaldsstrømme. Xenon har applikationer inden for forskellige områder, herunder belysning, rumfremd
Sammenføjning af xenongas ud af affaldsstrømmeMetal organiske rammer, med nanoporer og høj affinitet for xenon, kan adskille gassen fra luft eller affaldsstrømme. Xenon har applikationer inden for forskellige områder, herunder belysning, rumfremd -
 Den nye komposit forhindrer funktionsfejl i elektroniske enhederKredit:pixabay.com Forskere fra South Ural State University, i samarbejde med kolleger fra Hviderusland, Indien og Kina, har skabt et kompositmateriale til nanoelektronik. Materialet kan bruges so
Den nye komposit forhindrer funktionsfejl i elektroniske enhederKredit:pixabay.com Forskere fra South Ural State University, i samarbejde med kolleger fra Hviderusland, Indien og Kina, har skabt et kompositmateriale til nanoelektronik. Materialet kan bruges so -
 Ny type elektrolyt kan forbedre superkondensatorens ydeevneStore anioner med lange haler (blå) i ioniske væsker kan få dem til at samle sig selv til sandwichlignende dobbeltlagsstrukturer på elektrodeoverflader. Ioniske væsker med sådanne strukturer har meget
Ny type elektrolyt kan forbedre superkondensatorens ydeevneStore anioner med lange haler (blå) i ioniske væsker kan få dem til at samle sig selv til sandwichlignende dobbeltlagsstrukturer på elektrodeoverflader. Ioniske væsker med sådanne strukturer har meget -
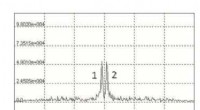 Forskere foreslår en ny metode til at opdage farlige nitrogenholdige væskerNMR -spektrum af mmoniumnitrat. Kredit:Galina Kupriyanova Et team af forskere fra Institut for Fysiske og Matematiske Videnskaber og Informationsteknologier ved Immanuel Kant Baltic Federal Univer
Forskere foreslår en ny metode til at opdage farlige nitrogenholdige væskerNMR -spektrum af mmoniumnitrat. Kredit:Galina Kupriyanova Et team af forskere fra Institut for Fysiske og Matematiske Videnskaber og Informationsteknologier ved Immanuel Kant Baltic Federal Univer
- Oprindelse og art:bekæmpelse af ulovlig skovhugst med videnskab
- Hvad er decibelniveauet på et jetfly?
- Forskellen mellem Sucralose & Fructose
- Hvis du sammenlignede en avocado med jorden, hvilken del af ville bedst repræsentere jordens kappe?…
- Klimapolitikker alene vil ikke redde Jordens mest forskelligartede tropiske skove
- Botulisme hos vandfugle:Dødelighedsrater og ny indsigt i, hvordan den spreder sig


