Hvordan er alkalimetaller til ædle gasser?
alkalimetaller:
* Elektronkonfiguration: Har en valenselektron i deres yderste skal.
* reaktivitet: Meget reaktiv, let mister deres enkelt valenselektron til dannelse af +1 kationer.
* Fysiske egenskaber: Blød, sølvfarvet og har lave smelte- og kogepunkter.
* Kemiske egenskaber: Reager kraftigt med vand til dannelse af hydroxider og brintgas.
* Eksempler: Lithium (Li), natrium (NA), kalium (K), Rubidium (RB), Cesium (CS), Francium (FR).
ædle gasser:
* Elektronkonfiguration: Har en fuld ydre skal af elektroner (normalt 8 elektroner, bortset fra helium, der har 2).
* reaktivitet: Meget ureaktiv på grund af deres stabile elektronkonfigurationer. De danner sjældent kemiske bindinger.
* Fysiske egenskaber: Farveløs, lugtfri og findes som gasser ved stuetemperatur.
* Kemiske egenskaber: Generelt inert (ikke-reaktivt), men kan danne forbindelser under ekstreme forhold.
* Eksempler: Helium (He), Neon (NE), Argon (AR), Krypton (KR), Xenon (XE), Radon (RN).
forhold:
Alkalimetaller og ædelgasser repræsenterer to ekstremer i reaktivitet. Alkalimetaller er meget reaktive på grund af deres ønske om at miste deres enkelt valenselektron og opnå en stabil ædle gaskonfiguration. På den anden side har ædle gasser allerede en stabil elektronkonfiguration, hvilket gør dem ekstremt ureaktive.
Nøgleforskelle i resumé:
| Funktion | Alkali -metaller | Ædle gasser |
| --------------- | --------------- | ------------- |
| Reaktivitet | Høj | Meget lav |
| Elektronkonfiguration | 1 Valence Electron | Fuld ydre skal |
| Fysisk tilstand | Solid (undtagen Francium) | Gas |
| Kemisk binding | Form let ioniske bindinger | Sjældent danner obligationer |
Selvom både alkalimetaller og ædelgasser indtager forskellige positioner på det periodiske tabel, er de grundlæggende forskellige i deres kemiske og fysiske egenskaber. De kontrasterende elektronkonfigurationer driver disse forskelle.
 Varme artikler
Varme artikler
-
 Forskere opdager ny teknik til at teste for virusinfektionerBrian Geiss holder en wire, der er en fjerdedel af størrelsen af et menneskehår. Kredit:John Eisele/ CSU Photography Et hold forskere fra Colorado State University har udviklet teknologi, der ka
Forskere opdager ny teknik til at teste for virusinfektionerBrian Geiss holder en wire, der er en fjerdedel af størrelsen af et menneskehår. Kredit:John Eisele/ CSU Photography Et hold forskere fra Colorado State University har udviklet teknologi, der ka -
 Forskere er pionerer med ny teknik til at omdanne brugte mælkeflasker til kajakker og lagertankeKredit:Queens University Belfast Forskere ved Queens University Belfast har opdaget nye måder at omdanne engangsplastikaffald til produkter som opbevaringstanke til vand og brændstof, og sportsart
Forskere er pionerer med ny teknik til at omdanne brugte mælkeflasker til kajakker og lagertankeKredit:Queens University Belfast Forskere ved Queens University Belfast har opdaget nye måder at omdanne engangsplastikaffald til produkter som opbevaringstanke til vand og brændstof, og sportsart -
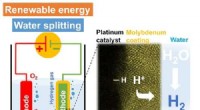 Belægning af molybdæn forbedrer effektiviteten af katalysatorer til fremstilling af brintEt højopløseligt elektronmikroskopbillede (til højre) af det elektrokatalytiske platinlag belagt med molybdæn. Platinet katalyserer hydrogenudviklingsreaktionen (til venstre) i surt medium fra protone
Belægning af molybdæn forbedrer effektiviteten af katalysatorer til fremstilling af brintEt højopløseligt elektronmikroskopbillede (til højre) af det elektrokatalytiske platinlag belagt med molybdæn. Platinet katalyserer hydrogenudviklingsreaktionen (til venstre) i surt medium fra protone -
 Metalionkatalysatorer og brintoverilte kan gøre plastproduktionen grønnereIllinois professor David Flaherty, ret, og kandidatstuderende Daniel Bregante arbejder på en grønnere måde at producere plast- og harpiksforstadier, der stammer fra fossile brændstoffer, en proces, de
Metalionkatalysatorer og brintoverilte kan gøre plastproduktionen grønnereIllinois professor David Flaherty, ret, og kandidatstuderende Daniel Bregante arbejder på en grønnere måde at producere plast- og harpiksforstadier, der stammer fra fossile brændstoffer, en proces, de


