Hvad er reaktionen mellem H2SO3 plus KCLO3 svarer til?
* redoxreaktion: Dette er en redoxreaktion, hvilket betyder, at elektroner overføres. Kclo₃ fungerer som et oxidationsmiddel (det får elektroner), og H₂so₃ fungerer som et reducerende middel (det mister elektroner).
* Dannelse af klorgas: Den primære reaktion involverer oxidation af sulfit (SO₃²⁻) til sulfat (so₄²⁻) og reduktion af chlorat (clo₃⁻) til chlorgas (cl₂). Denne klorgas er meget giftig og kan være farlig.
Forenklet reaktionsligning:
3H₂so₃ (aq) + KCLO₃ (aq) → 3H₂so₄ (aq) + kCl (aq) + cl₂ (g)
Vigtige overvejelser:
* varme og katalysatorer: Reaktionen kan accelereres af varme og tilstedeværelsen af katalysatorer.
* Udvikling af klorgas: Denne reaktion frigiver klorgas, som er en giftig og ætsende gas. Det bør kun udføres i et godt ventileret område med passende sikkerhedsforholdsregler.
* Dannelse af kaliumsulfat: Reaktionen producerer også kaliumsulfat (K₂so₄), som er et opløseligt salt.
Det er vigtigt at forstå, at denne reaktion er meget eksoterm og producerer giftig klorgas. Det skal kun udføres af uddannede fagfolk i et kontrolleret miljø med korrekt sikkerhedsudstyr.
Hvis du er interesseret i at lære mere om specifikke reaktionsbetingelser, produkter eller sikkerhedsforholdsregler, kan du konsultere en kemisk lærebog eller en kvalificeret kemiker.
Sidste artikelEr Styrofoam en syre eller en base?
Næste artikelHvad menes med bedring i kemi?
 Varme artikler
Varme artikler
-
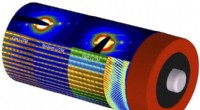 Kortlægning af batterimaterialer med atompræcisionAtomopløsning scanning transmission elektronmikroskopi billeder og elektron diffraktion mønstre, arrangeret på en gengivelse af et batteri, vise, hvordan strukturen af lithiumrige og manganrige over
Kortlægning af batterimaterialer med atompræcisionAtomopløsning scanning transmission elektronmikroskopi billeder og elektron diffraktion mønstre, arrangeret på en gengivelse af et batteri, vise, hvordan strukturen af lithiumrige og manganrige over -
 Giver brændte knogler liv igen ved hjælp af 3-D-teknologiKredit:CC0 Public Domain Retsmedicinere ved University of Portsmouth har opdaget en ny måde at præsentere skrøbelige beviser på, ved at rekonstruere et puslespil af menneskelige knoglefragmenter v
Giver brændte knogler liv igen ved hjælp af 3-D-teknologiKredit:CC0 Public Domain Retsmedicinere ved University of Portsmouth har opdaget en ny måde at præsentere skrøbelige beviser på, ved at rekonstruere et puslespil af menneskelige knoglefragmenter v -
 Nyt open source-websted indeholder tegninger til lab-on-a-chip-enhederMetafludics.org, et nyt MIT open source-websted, leverer tegninger til mikrofluidiske dele. På billedet er et par billeder fra hjemmesiden. Kredit:Metafludics.org Et nyt MIT-designet open source-w
Nyt open source-websted indeholder tegninger til lab-on-a-chip-enhederMetafludics.org, et nyt MIT open source-websted, leverer tegninger til mikrofluidiske dele. På billedet er et par billeder fra hjemmesiden. Kredit:Metafludics.org Et nyt MIT-designet open source-w -
 Mekanisk vejrtrækning i smarte vinduerForskere undersøger måder at forhindre en polymers mekaniske vejrtrækning, ” en effekt, der får lagene i et smart vindue til at delaminere. Kredit:Purdue University billede/Xiaokang Wang Smarte vi
Mekanisk vejrtrækning i smarte vinduerForskere undersøger måder at forhindre en polymers mekaniske vejrtrækning, ” en effekt, der får lagene i et smart vindue til at delaminere. Kredit:Purdue University billede/Xiaokang Wang Smarte vi
- Nepals lov om sociale medier vækker bekymringer om ytringsfrihed
- Apple -patentsnak:Endnu en nøglefri undren, da bilen ser dig nærme dig
- Hvad fuglenæb siger om tropisk biodiversitet
- Optimeret LIBS-teknik forbedrer analyse af atomreaktormaterialer
- Røg fra skovbrand sværter de forhistoriske græske bymure
- TDRS:En æra med kontinuerlig rumkommunikation


