Hvilken konklusion kan du gøre med hensyn til polariteten af kulbrinter?
* sammensætning: Kulbrinter består af kun carbon- og brintatomer. Både kulstof og brint har lignende elektronegativitetsværdier, hvilket betyder, at de deler elektroner temmelig jævnt i deres bindinger.
* binding: C-H-bindingerne inden for kulbrinter er i det væsentlige ikke-polære kovalente bindinger. Dette betyder, at der ikke er nogen signifikant forskel i elektrondensitet mellem kulstof- og brintatomer.
* form: Formen af carbonhydridmolekyler spiller også en rolle. Lineære og forgrenede kulbrinter har symmetriske former, hvilket yderligere bidrager til deres ikke -polære karakter.
Der er dog nogle undtagelser:
* umættede kulbrinter: Kulbrinter med dobbelt- eller tredobbelt bindinger (som alkener og alkyner) kan have en vis polær karakter på grund af elektrondensiteten omkring dobbelt- eller tredobbeltbindingen.
* store, komplekse kulbrinter: Meget store kulbrinter med unikke former eller funktionelle grupper (som aromatiske ringe) kan udvise en vis polaritet.
Kortfattet:
Mens de fleste kulbrinter betragtes som ikke -polære på grund af deres sammensætnings- og bindingstyper, er der undtagelser, hvor faktorer som umættelighed eller strukturel kompleksitet kan føre til en vis grad af polaritet.
 Varme artikler
Varme artikler
-
 Mobiltelefonmikroskop registrerer den tavse dræber af honningbierDemonstration af brugen af den bærbare smartphone-baserede parasitsensor. Kredit:UCLA Engineering Institute for Technology Advancement Bier er blandt de vigtigste arter, der er ansvarlige for at
Mobiltelefonmikroskop registrerer den tavse dræber af honningbierDemonstration af brugen af den bærbare smartphone-baserede parasitsensor. Kredit:UCLA Engineering Institute for Technology Advancement Bier er blandt de vigtigste arter, der er ansvarlige for at -
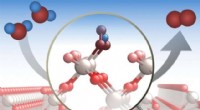 Undersøgelsen afslører detaljer om, hvordan en udbredt katalysator spalter vandIltudviklingsreaktioner er vigtige i en række industrielle processer. En ny undersøgelse giver en detaljeret analyse af processen på molekylært niveau. Som illustreret her, forskerne analyserede, hvor
Undersøgelsen afslører detaljer om, hvordan en udbredt katalysator spalter vandIltudviklingsreaktioner er vigtige i en række industrielle processer. En ny undersøgelse giver en detaljeret analyse af processen på molekylært niveau. Som illustreret her, forskerne analyserede, hvor -
 Retskemiske laserteknik skelner mellem menneske- og dyreblodIgor Lednev har en prototype af en scanner, der kan bruges af retshåndhævere til at analysere biologiske pletter på gerningssteder. Kredit:University at Albany Ny forskning udgivet af retskemiker
Retskemiske laserteknik skelner mellem menneske- og dyreblodIgor Lednev har en prototype af en scanner, der kan bruges af retshåndhævere til at analysere biologiske pletter på gerningssteder. Kredit:University at Albany Ny forskning udgivet af retskemiker -
 Naturlig mineralsk hackmanit demonstrerer meget gentagelig farveændringsevneHackmanit bliver lilla under UV-bestråling, og farven falmer tilbage til hvid på få minutter under almindeligt hvidt lys. Denne prøve er fra Grønland. Kredit:Mika Lastusaari Mens de undersøgte hack
Naturlig mineralsk hackmanit demonstrerer meget gentagelig farveændringsevneHackmanit bliver lilla under UV-bestråling, og farven falmer tilbage til hvid på få minutter under almindeligt hvidt lys. Denne prøve er fra Grønland. Kredit:Mika Lastusaari Mens de undersøgte hack
- Ikke så fantastisk engangsplastik for at få en miljøvenlig makeover
- Video:Kunne mennesker overleve årtier i et nedfaldsly?
- BMW viser et rekordstort nettooverskud på 8,7 mia. euro for 2017
- Google stopper med Google Oversæt på det kinesiske fastland
- Hvad er retningen af en tværgående bølge i forhold til dens bevægelse?
- Ny undersøgelse belyser, hvordan Salmonella spreder sig i kroppen


