Hvad sker der med kemiske bindinger, når nye forbindelser dannes i en reaktion?
1. Breaking eksisterende obligationer:
* reaktanter: Startmaterialerne for en kemisk reaktion har deres eget sæt kemiske bindinger, der holder deres atomer sammen.
* Energiindgang: Energi kræves for at bryde disse eksisterende obligationer. Denne energi kan komme fra forskellige kilder som varme, lys eller elektricitet.
2. Omarrangering af atomer:
* Kollision og aktiveringsenergi: Reaktanterne kolliderer med nok energi (aktiveringsenergi) til at overvinde bindingsstyrken og bryde fra hinanden.
* Dannelse af mellemarter: Atomer og fragmenter kan eksistere kort i ustabile mellemstater under reaktionen.
3. Danner nye obligationer:
* attraktion: Atomer og fragmenter fra de ødelagte bindinger omarrangeres, danner nye attraktioner (bindinger) baseret på deres elektronegativitet og andre faktorer.
* Produktdannelse: Dette resulterer i dannelsen af nye, mere stabile molekyler kaldet produkter.
Nøglekoncepter:
* Energibesparelse: Kemiske reaktioner overholder loven om energi. Systemets samlede energi (inklusive reaktanter og produkter) forbliver konstant.
* eksotermisk vs. endotermisk: Reaktioner kan enten frigive energi (eksotermisk, som brændende brændstof) eller kræve energiindgang (endotermisk, som fotosyntesen).
Eksempel:
Overvej reaktionen mellem natrium (NA) og chlor (CL) til dannelse af natriumchlorid (NaCl):
* reaktanter: NA har en enkelt ydre elektron, CL har 7.
* Bond Breaking: Bindingen, der holder kloratomerne sammen, går i stykker.
* omarrangement: Natriumatomet mister sit ydre elektron for at blive en positivt ladet ion (Na+). Chloratomet får elektronet til at blive en negativt ladet ion (CL-).
* Ny obligationsdannelse: De modsatte ladninger af ionerne tiltrækker og danner en ionisk binding for at skabe den stabile sammensatte NaCl (bordsalt).
Kort sagt involverer kemiske reaktioner nedbrydning af eksisterende bindinger mellem atomer i reaktanter og dannelsen af nye bindinger for at skabe forskellige forbindelser (produkter).
 Varme artikler
Varme artikler
-
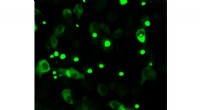 Ny indsigt i Huntingtons sygdomHumane celler, der producerer fluorescens-mærket mutant huntingtin. Muteret huntingtin har en tendens til at akkumulere, hvilket er patologisk og synligt i form af prikker. Kredit:Bremen Universitet
Ny indsigt i Huntingtons sygdomHumane celler, der producerer fluorescens-mærket mutant huntingtin. Muteret huntingtin har en tendens til at akkumulere, hvilket er patologisk og synligt i form af prikker. Kredit:Bremen Universitet -
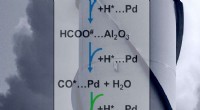 Forskere viser, hvordan man styrer katalysator, der gør en drivhusgas til et brændstof eller råst…De grønne pile viser det afgørende trin i styringen af reaktionernes slutprodukter:metan eller kulilte. Kredit:Scott Butner Hvad hvis vi kunne vende kuldioxid, CO2, til en værdifuld ressource? B
Forskere viser, hvordan man styrer katalysator, der gør en drivhusgas til et brændstof eller råst…De grønne pile viser det afgørende trin i styringen af reaktionernes slutprodukter:metan eller kulilte. Kredit:Scott Butner Hvad hvis vi kunne vende kuldioxid, CO2, til en værdifuld ressource? B -
 MRI-scanning hjælper med næste generations batteridesignKredit:CC0 Public Domain Magnetisk resonansbilleddannelse (MRI) kan give en effektiv måde at understøtte udviklingen af den næste generation af højtydende genopladelige batterier, ifølge forskni
MRI-scanning hjælper med næste generations batteridesignKredit:CC0 Public Domain Magnetisk resonansbilleddannelse (MRI) kan give en effektiv måde at understøtte udviklingen af den næste generation af højtydende genopladelige batterier, ifølge forskni -
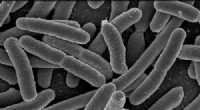 Forskere leder bakterier med udvidet genetisk kode til at udvikle ekstrem varmetoleranceEscherichia coli. Kredit:Rocky Mountain Laboratories, NIAID, NIH I de seneste år, forskere har konstrueret bakterier med udvidede genetiske koder, der producerer proteiner fremstillet af et breder
Forskere leder bakterier med udvidet genetisk kode til at udvikle ekstrem varmetoleranceEscherichia coli. Kredit:Rocky Mountain Laboratories, NIAID, NIH I de seneste år, forskere har konstrueret bakterier med udvidede genetiske koder, der producerer proteiner fremstillet af et breder
- NASA får et kig om natten og under motorhjelmen på orkanen Irma
- Ren dopingstrategi giver mere responsive fototransistorer
- Hvad er videnskabelige spørgsmål baseret på?
- Er syrlig smag en kemisk egenskab ved en antacidabord?
- Nyt for tre typer ekstrem-energi rumpartikler:Teori viser ensartet oprindelse
- Forklar, hvorfor et falskt positivt reaktionsresultat kan opnås med citratmedium?


