Ny indsigt i Huntingtons sygdom
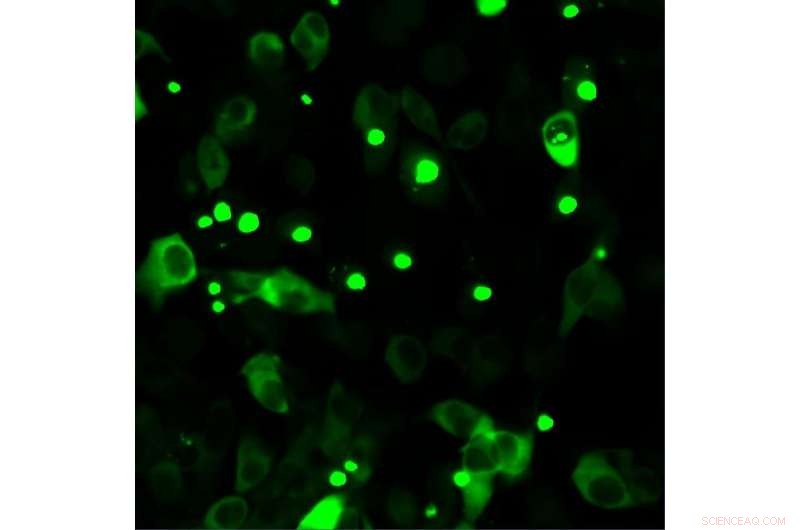
Humane celler, der producerer fluorescens-mærket mutant huntingtin. Muteret huntingtin har en tendens til at akkumulere, hvilket er patologisk og synligt i form af prikker. Kredit:Bremen Universitet
Huntingtons chorea er en arvelig sygdom, der fører til kognitive og motoriske svækkelser og død. Forskere ved universitetet i Bremen har arbejdet sammen med internationale partnere for at belyse mekanismen, hvorved det muterede huntingtin-protein kan holdes i skak.
"Vi har afsløret en mekanisme, hvorved kroppens egne proteinfoldningshjælpere holder det muterede huntingtin-protein i skak," forklarer projektleder og professor Janine Kirstein ved universitetet i Bremen. Proteinfoldningshjælpere tillader proteiner at påtage sig og bevare deres korrekte struktur for at udføre deres mangefacetterede funktioner. Forskerne kendte allerede til tre af hjælperne, men hvad de endnu ikke vidste var, hvordan bindingen med det muterede huntingtin-protein så ud, hvilket af de tre foldningshjælpemidler, der kunne genkende det muterede protein, og hvordan dets binding så ud.
"Vi har nu været i stand til at identificere dette ved hjælp af tværbindingsmassespektrometrimetoden," siger biokemikeren. Denne metode kan præcist bestemme proteininteraktioner. Der var dog stadig lang vej at gå med hensyn til at forstå båndet. "Det var kun gennem modellering, at vi var i stand til bedre at forstå interaktionen mellem proteinfoldende hjælpere og mutant huntingtin."
Succesfuld forskning gennem dokumenteret tværfaglighed
Succesen med disse nye indsigter ligger i at praktisere tværfaglighed:"At vi var i stand til at opnå vores resultater med en sådan præcision, skyldtes primært det fremragende samarbejde mellem fakulteterne for biologi/kemi og produktionsteknik ved universitetet i Bremen," siger Kirstein. "I biokemi havde vi brug for forskere til vores projekt, som kunne støtte os i vores eksperimentelle laboratoriearbejde med computerstøttede modeller".
Hendes kandidatstuderende Yasmin Richter fandt den nødvendige ekspertise inden for ingeniørvidenskab sammen med sin tidligere medstuderende på kandidatuddannelsen i Biokemi &Molekylær Biologi, Isabell Grothaus. Hun tager sin doktorgrad i arbejdsgruppen ledet af Dr. Susan Köppen og professor Lucio Colombi Ciacchi. Sådan udviklede de to yngre forskere et samarbejde mellem de to fakulteter. "Ingeniørerne simulerede bindingen mellem proteinfoldningshjælpemidlerne og det muterede huntingtin-protein på en computer for os, og vi var derefter i stand til eksperimentelt at validere modelleringen i vores laboratorium med oprensede proteiner og i cellekulturer," forklarer Kirstein.
En anden hindring var den hidtil ukendte struktur af det muterede huntingtin-protein. Samarbejdspartnerne Martin Kulke og Josh Vermaas fra Michigan State University i USA var i stand til at hjælpe til her og postulerede en struktur, der ville gøre det muligt at udføre modelleringen på computeren. En anden vigtig samarbejdspartner var Fan Liu med de massespektrometriske eksperimenter udført på Leibniz Research Institute for Molecular Pharmacology i Berlin. Det er også her, Kirstein ledede en arbejdsgruppe indtil 2019 forud for hendes udnævnelse til universitetet i Bremen.
Bygger på forskningsresultater
"Med dette arbejde er det lykkedes os at forstå den mekanisme, hvorved en proteinfoldningshjælper selektivt detekterer et muteret sygdomsassocieret protein og gør det uskadeligt. Dette alene er ikke nok til terapeutisk brug," siger Kirstein. "Men du kan bygge videre på disse resultater og udvikle strategier til specifikt at inducere eller stabilisere disse kropsspecifikke foldehjælpemidler for at undertrykke toksiciteten af muteret huntingtin."
Forskningen blev offentliggjort i Nature Communications . + Udforsk yderligere
Humane membranproteiner rammer evolutionær balance
 Varme artikler
Varme artikler
-
 Syntetiske receptorer kan omkoble cellefunktioner og minimere bivirkningerKredit:CC0 Public Domain En af udfordringerne ved moderne farmakologi er specificitet. På trods af terapeutiske virkninger, medicin kan ofte have bivirkninger. Det biologiske grundlag for dette ha
Syntetiske receptorer kan omkoble cellefunktioner og minimere bivirkningerKredit:CC0 Public Domain En af udfordringerne ved moderne farmakologi er specificitet. På trods af terapeutiske virkninger, medicin kan ofte have bivirkninger. Det biologiske grundlag for dette ha -
 Video:Den mærkelige kemi, der truer mesterværksmalerierKredit:The American Chemical Society En god kunsthandler kan virkelig rydde op på dagens marked, men ikke når en eller anden underlig kemi ødelægger mesterværker. Kunstkonservatorer begyndte at l
Video:Den mærkelige kemi, der truer mesterværksmalerierKredit:The American Chemical Society En god kunsthandler kan virkelig rydde op på dagens marked, men ikke når en eller anden underlig kemi ødelægger mesterværker. Kunstkonservatorer begyndte at l -
 Forskere kan regne med forbedret proteomikmetodePrinceton Universitys Martin Wühr har forbedret sin metode til nøjagtigt at tælle de proteiner, der er til stede i en celle under forskellige omstændigheder. TMc+-metoden er i en slags sweet spot samm
Forskere kan regne med forbedret proteomikmetodePrinceton Universitys Martin Wühr har forbedret sin metode til nøjagtigt at tælle de proteiner, der er til stede i en celle under forskellige omstændigheder. TMc+-metoden er i en slags sweet spot samm -
 Bakterielle enzymer:Europiums biologiske rollePå billedet er den største fumarole (La Bocca Grande) i Solfatara-krateret vist, hvor den REE-afhængige bakterie Methylacidiphilum fumariolicum SolV først blev opdaget. Kredit:Huub Op den Camp Rar
Bakterielle enzymer:Europiums biologiske rollePå billedet er den største fumarole (La Bocca Grande) i Solfatara-krateret vist, hvor den REE-afhængige bakterie Methylacidiphilum fumariolicum SolV først blev opdaget. Kredit:Huub Op den Camp Rar
- Flypiloter kan normalt ikke få øje på en indtrængende drone, viser undersøgelse
- Ultralydsangreb er usandsynligt, men tilfældig eksponering giver masser af problemer
- Træringe giver vital information til forbedrede klimaforudsigelser
- Kønsantagelser skader fremskridt med hensyn til klimatilpasning og modstandsdygtighed
- Svag superplanet opdaget af radioteleskop
- Iværksættere:Få varemærket til at lykkes, siger forskning


