Hvorfor er ingen to emissionsspektre for forskellige elementer nogensinde de samme?
* Elektronenerginiveau: Atomer har specifikke energiniveauer, som elektroner kan besætte. Disse niveauer er kvantiseret, hvilket betyder, at elektroner kun kan eksistere ved visse diskrete energiforhold.
* ophidsede stater: Når et atom absorberer energi (f.eks. Varme eller lys), springer en elektron til et højere energiniveau. Dette kaldes en ophidset tilstand.
* Emission: Når den ophidsede elektron vender tilbage til et lavere energiniveau, frigiver det den absorberede energi som en foton af lys. Energiforskellen mellem de to niveauer bestemmer bølgelængden af det udsendte lys.
* unikke "fingeraftryk": Hvert element har et unikt arrangement af energiniveauet. Dette betyder, at energiforskellene mellem niveauer og derfor bølgelængderne af udsendt lys også er unikke for dette element.
Tænk på det sådan:
* Forestil dig, at hvert element har et specifikt sæt trapper, hvert trin, der repræsenterer et energiniveau.
* Højdeforskellen mellem trinnene bestemmer energien på det lys, der udsendes, når et elektron bevæger sig mellem dem.
* Da hvert element har sin egen unikke "trappe", vil det udsendte lys også være unikt.
Derfor producerer hvert element et unikt mønster af farvede linjer (emissionsspektrum) svarende til de specifikke energiovergange af dets elektroner. Dette giver os mulighed for at identificere elementer baseret på deres emissionsspektre.
Sidste artikelHvordan adskilles olie og vand?
Næste artikelHvad er navnet på fosforion?
 Varme artikler
Varme artikler
-
 Den banebrydende kunstige fotosyntese kommer tættere påKredit:Pixabay/CC0 Public Domain Forestil dig, at vi kunne gøre, hvad grønne planter kan:fotosyntese. Så kunne vi få dækket vores enorme energibehov med dybgrøn brint og klimaneutral biodiesel. For
Den banebrydende kunstige fotosyntese kommer tættere påKredit:Pixabay/CC0 Public Domain Forestil dig, at vi kunne gøre, hvad grønne planter kan:fotosyntese. Så kunne vi få dækket vores enorme energibehov med dybgrøn brint og klimaneutral biodiesel. For -
 Det tidløse, komplementær smag af østers og champagne - forklaretKredit:CC0 Public Domain Matchende priser er ikke den eneste grund til, at østers og champagne passer så godt sammen. Det viser en undersøgelse offentliggjort af Københavns Universitet i dag. en u
Det tidløse, komplementær smag af østers og champagne - forklaretKredit:CC0 Public Domain Matchende priser er ikke den eneste grund til, at østers og champagne passer så godt sammen. Det viser en undersøgelse offentliggjort af Københavns Universitet i dag. en u -
 3-D print med applikationer i den farmaceutiske industriKredit:CC0 Public Domain University of Sevilla forskere, i samarbejde med University of Nottingham, har formået at skabe det første billede af nanopartikler af stabiliseret guld med biologisk nedb
3-D print med applikationer i den farmaceutiske industriKredit:CC0 Public Domain University of Sevilla forskere, i samarbejde med University of Nottingham, har formået at skabe det første billede af nanopartikler af stabiliseret guld med biologisk nedb -
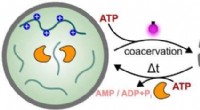 Hvordan lys kan bruges til at styre processer i syntetiske cellerKredit:Shoupeng Cao et al., Angewandte Chemie International Edition (2022). DOI:10.1002/anie.202205266 Syntetiske (kunstigt producerede) celler kan efterligne visse funktioner af biologiske celler.
Hvordan lys kan bruges til at styre processer i syntetiske cellerKredit:Shoupeng Cao et al., Angewandte Chemie International Edition (2022). DOI:10.1002/anie.202205266 Syntetiske (kunstigt producerede) celler kan efterligne visse funktioner af biologiske celler.
- Er Jorden en stor eller lille planet-?
- Hvad er den grå elektriske ledning?
- Ny form for silicium kunne muliggøre næste generations elektroniske og energienheder
- Ny 3-D printer kan skabe komplekse biologiske væv
- Hvordan Rissos delfiner finder en balance mellem at holde vejret og finde mad
- Udvikling af nye smarte bløde materialer:Syntese af en pH-reagerende dendroniseret poly(substituere…


