Hvis elementerne i periodisk tabel blev sekventeret med densitet fra mindste til største, hvad ville de have til fælles, ville lignende kemiske og fysiske egenskaber?
Her er hvorfor:
* densitet påvirkes af flere faktorer: Densitet er en funktion af masse og volumen. Mens atommasse generelt øges, når du bevæger dig over og ned i den periodiske tabel, ændres atomstørrelsen (volumen) også på komplekse måder. Dette betyder:
* Elementer i samme periode (række) kan have drastisk forskellige densiteter på grund af forskelle i atomstørrelse.
* Elementer i den samme gruppe (kolonne) kan også have forskellige densiteter, igen på grund af, hvordan atomstørrelse ændrer sig ned i en gruppe.
* Kemiske og fysiske egenskaber bestemmes ved elektronkonfiguration: De kemiske og fysiske egenskaber ved elementer bestemmes primært af deres elektronkonfiguration, især antallet og arrangementet af valenselektroner (elektroner i den yderste skal).
Lad os illustrere med eksempler:
* lithium (Li) vs. beryllium (BE): Li er mindre tæt end være, selvom det er en højere atommasse. Dette skyldes, at Li har en større atomradius.
* osmium (OS) vs. Mercury (HG): Osmium er det tætteste element, mens Merkur er en væske ved stuetemperatur. Denne forskel i densitet er primært drevet af deres meget forskellige elektronkonfigurationer, og hvordan de interagerer for at danne bindinger.
Konklusion: Mens densitet er en nyttig egenskab, korrelerer den ikke direkte med de kemiske og fysiske egenskaber, der er defineret ved elektronkonfiguration. At arrangere elementer med densitet ville ikke afsløre et klart mønster af lignende opførsel.
 Varme artikler
Varme artikler
-
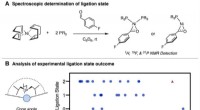 Forudsigelse af fosfinreaktivitet med en simpel metrik%Vbur (min) deskriptoren er unikt i stand til at forudsige spektroskopisk ligeringstilstandsudfald, afslører reaktivitetsklipper i organometallisk kemi. Kredit:Doyle Lab Fosfiner er blandt de vigt
Forudsigelse af fosfinreaktivitet med en simpel metrik%Vbur (min) deskriptoren er unikt i stand til at forudsige spektroskopisk ligeringstilstandsudfald, afslører reaktivitetsklipper i organometallisk kemi. Kredit:Doyle Lab Fosfiner er blandt de vigt -
 Brug af lys til at udvide omfanget af carbonyleringsreaktionerEn lysbaseret strategi for den oxidative addition-reduktive elimineringscyklus. (A) Modsatrettede påvirkninger af disse operationer. L, ligand; M, metal. (B og C) Deres begrænsende anvendelse i carbon
Brug af lys til at udvide omfanget af carbonyleringsreaktionerEn lysbaseret strategi for den oxidative addition-reduktive elimineringscyklus. (A) Modsatrettede påvirkninger af disse operationer. L, ligand; M, metal. (B og C) Deres begrænsende anvendelse i carbon -
 Denne RNA-baserede teknik kunne gøre genterapi mere effektivKredit:CC0 Public Domain Levering af funktionelle gener til celler for at erstatte muterede gener, en metode kendt som genterapi, har potentiale til behandling af mange former for sygdomme. De tid
Denne RNA-baserede teknik kunne gøre genterapi mere effektivKredit:CC0 Public Domain Levering af funktionelle gener til celler for at erstatte muterede gener, en metode kendt som genterapi, har potentiale til behandling af mange former for sygdomme. De tid -
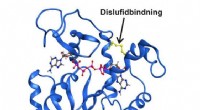 At få øje på det usynligeHøjopløsningsrøntgenstruktur af enzymet adenylatkinase fanget i en forbigående strukturel tilstand af en kovalent disulfidbinding. Kredit:Umeå Universitet Det er lykkedes kemikere ved Umeå Univers
At få øje på det usynligeHøjopløsningsrøntgenstruktur af enzymet adenylatkinase fanget i en forbigående strukturel tilstand af en kovalent disulfidbinding. Kredit:Umeå Universitet Det er lykkedes kemikere ved Umeå Univers
- Hvor mange dage er der i et år på Jupiter?
- Casestudier viser, hvordan kvasi-statslige organisationer kunne styrke styringen af klimatilpasnin…
- Iskernekemi-undersøgelse udvider indsigt i havisens variabilitet på den sydlige halvkugle
- Hvad ville være soltiden for en person, der lever 4 graders længdegrad østlige middagsmeridian?
- Har alle levende organismer brug for det endokrine system for at overleve?
- Hvorfor er en fersken en dårlig model for jordlag?


