At få øje på det usynlige
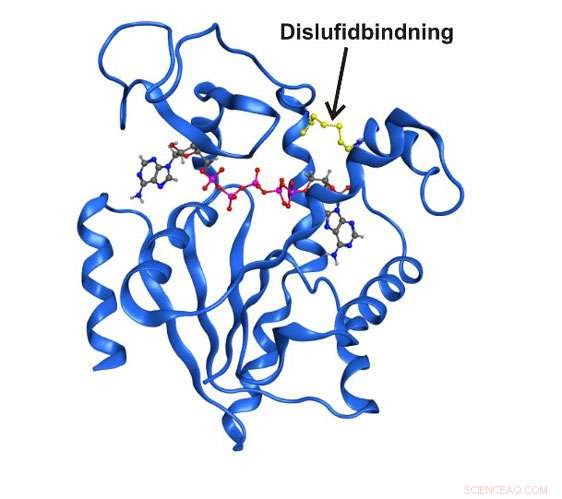
Højopløsningsrøntgenstruktur af enzymet adenylatkinase fanget i en forbigående strukturel tilstand af en kovalent disulfidbinding. Kredit:Umeå Universitet
Det er lykkedes kemikere ved Umeå Universitet at kortlægge strukturer og funktioner i en forbigående enzymtilstand. Ved at modificere enzymet adenylatkinase, forskere var i stand til at isolere molekylet og studere det ved hjælp af de kvantitative teknikker røntgenkrystallografi og nuklear magnetisk resonans (NMR) spektroskopi. Resultaterne er blevet offentliggjort i tidsskriftet PNAS .
"Vi er nu kommet et skridt nærmere en generel forståelse af, hvordan enzymer fungerer. Dette er afgørende for fremtidige designs af nye enzymer i bioteknologiske anvendelser, siger Magnus Wolf-Watz, lektor ved Institut for Kemi ved Umeå Universitet.
Biologisk liv er afhængig af et stort antal cellulære, kemiske reaktioner, der ofte er ekstremt langsomme og kan tage måneder eller år at gennemføre. For at kemiske og biologiske tidsskalaer skal matche, kemiske reaktioner fremskyndes i celler ved brug af enzymer som effektive biokatalysatorer.
I løbet af det sidste årtis forskning er det blevet gjort klart, at enzymstrukturer, der kun eksisterer kortvarigt og forbigående, kan være helt afgørende for den katalytiske funktion. Indtil nu, det har ikke været muligt at studere disse tilstande i detaljer på grund af det simple faktum, at de er usynlige for traditionelle spektroskopiske teknikker. Nu, forskere ved Kemisk Institut ved Umeå Universitet i Sverige har formået at fange en forbigående tilstand, der er central for funktionen i det essentielle enzym adenylatkinase. Den kortvarige tilstand var mulig at berige ved at udskifte to aminosyrer i enzymet med den reaktive aminosyre cystein.
"Det er første gang, at nogen har formået at studere en forbigående enzymtilstand direkte ved hjælp af spektroskopiske og kvantitative teknikker. Med brugen af vores metoder, vi var i stand til i detaljer at beskrive både strukturen og funktionen af enzymet i den specifikke forbigående fase, siger Magnus Wolf-Watz, der ledede undersøgelsen sammen med postdoc Michael Kovermann, som nu har en gruppeledelse ved universitetet i Konstanz i Tyskland.
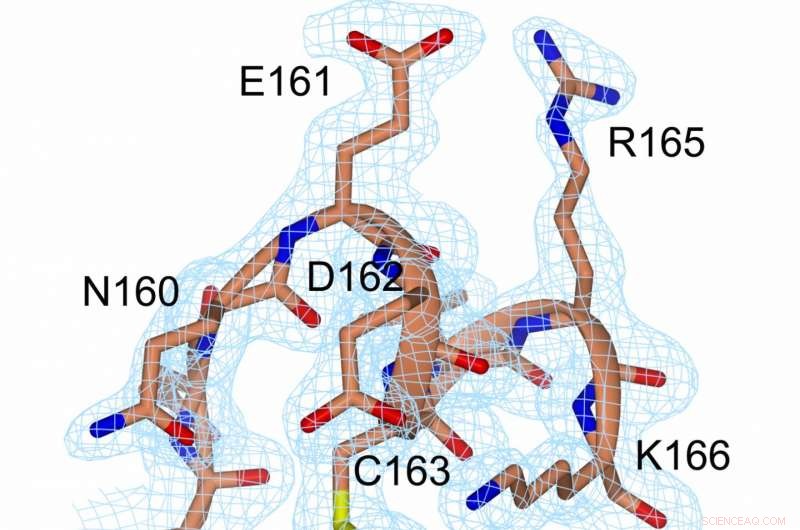
En repræsentation af elektrondensiteten ved disulfidbindingen (gul, mellem C56 og C163) og i dens nærhed. Kredit:Prof. Michael Kovermann, Universitetet i Konstanz
Resultaterne viste, at funktionen i et enzym er helt afhængig af dets iboende dynamik, og uden dynamik ville enzymet blive gjort ubrugeligt. Desuden, det viste sig, at den forbigående tilstand bandt dets substratmolekyler meget stærkere end de naturlige proteiner. Resultaterne gav os yderligere fingerpeg om, hvordan enzymer kan fremskynde reaktioner med en så utrolig specificitet og effektivitet. Alt imens, den metode, vi udviklede, kan generelt være nyttig i undersøgelser af andre enzymer."
Magnus Wolf Watz' NMR-team har samarbejdet med røntgenkrystallograferne Uwe H. Sauer og Elisabeth Sauer-Eriksson om undersøgelsen.
"Vi har haft et langsigtet og meget produktivt samarbejde. Dette er et godt eksempel på, hvor vigtig den samarbejdsstemning, der findes på Umeå Universitet, er, og hvordan vi skal værne om og videreudvikle det i fremtiden, " siger Magnus Wolf-Watz.
 Varme artikler
Varme artikler
-
 5. klasse kemisk forandringsaktivitetEt kemiprojekt for 5. graders bør fremstå som sjovt og mindre som læring. Illustrerende en kemisk reaktion ved at ændre farven på en øre passer til regningen. Dette er et eksperiment, som en 10-årig k
5. klasse kemisk forandringsaktivitetEt kemiprojekt for 5. graders bør fremstå som sjovt og mindre som læring. Illustrerende en kemisk reaktion ved at ændre farven på en øre passer til regningen. Dette er et eksperiment, som en 10-årig k -
 Metalkatalyserede reaktioner gjort enantioselektive ved brug af chiral kationKredit:University of Cambridge Forskere her har fundet frem til en strategi for at gøre en overgangsmetalkatalyseret kemisk reaktion enantioselektiv ved brug af en chiral kation. Arbejdet blev udf
Metalkatalyserede reaktioner gjort enantioselektive ved brug af chiral kationKredit:University of Cambridge Forskere her har fundet frem til en strategi for at gøre en overgangsmetalkatalyseret kemisk reaktion enantioselektiv ved brug af en chiral kation. Arbejdet blev udf -
 Forskere søger at udvikle antiviral membranmaskeUniversity of Kentucky-forsker Dibakar Bhattacharyya har konceptet og midlerne til at udvikle en medicinsk ansigtsmaske, der vil fange og deaktivere COVID-19-virussen ved kontakt. Kredit:University of
Forskere søger at udvikle antiviral membranmaskeUniversity of Kentucky-forsker Dibakar Bhattacharyya har konceptet og midlerne til at udvikle en medicinsk ansigtsmaske, der vil fange og deaktivere COVID-19-virussen ved kontakt. Kredit:University of -
 Samtidig måling af biofysiske egenskaber og position af enkelte celler i en mikroenhedSkematisk design af den elektriske sensingregion i den mikrofluidiske impedanscytometrianordning. Den laterale position af enkelte partikler eller celler, der strømmer gennem de N-formede elektroder,
Samtidig måling af biofysiske egenskaber og position af enkelte celler i en mikroenhedSkematisk design af den elektriske sensingregion i den mikrofluidiske impedanscytometrianordning. Den laterale position af enkelte partikler eller celler, der strømmer gennem de N-formede elektroder,
- Plastik i trådkors på FN's miljøforum
- Øvelse i et førsteårs skrivekursus øger fastholdelsen på universiteter med bred adgang
- Hvordan man laver slime til børn uden borax, madfarvning og hvid lim
- Forskere studerer problemet med hydrodynamisk stabilitet af Keplerian flow
- Koordinerede bestræbelser på Twitter for at blande sig i amerikanske valg er udenlandsk-baserede
- Forskere ser molekyler i en lysudløst katalysatorring som et ensemble af klokker


