Metalkatalyserede reaktioner gjort enantioselektive ved brug af chiral kation
Kredit:University of Cambridge
Forskere her har fundet frem til en strategi for at gøre en overgangsmetalkatalyseret kemisk reaktion enantioselektiv ved brug af en chiral kation. Arbejdet blev udført i Dr. Robert Phipps' forskningsgruppe.
Tidligere, Robert siger, mens chirale kationer er blevet meget brugt som organokatalysatorer, at bringe dem ind i kemiske reaktioner katalyseret af overgangsmetaller for at kontrollere enantioselektiviteten af reaktionen har været meget sjældnere. Nu, efter to års hårdt arbejde "og en masse teamindsats, " det er lykkedes dem at gøre det.
Deres arbejde, udgivet i Videnskab , er "i det væsentlige et bevis på, at du kan gøre dette, og at det kan gøres på en udfordrende reaktionstype, der har vist sig hård med eksisterende tilgange, " han siger.
Phipps-gruppen udvikler metoder til syntese af små molekyler, såsom stoffer. I de sidste par år, de har brugt betydelig indsats på at udvikle katalysatorer, der er i stand til at kontrollere positionsselektiviteten i kemiske reaktioner – dvs. kontrollerer præcist hvilket punkt på molekylet den kemiske reaktion finder sted. Det har de gjort ved at udvikle ligander til overgangsmetalkatalysatorer, der forankrer katalysatoren til en bestemt position på molekylet.
Og de har ledt efter måder at forfine liganderne endnu mere, så de er i stand til at gøre dem ikke bare positionelt selektive, men også enantioselektive. Enantiomerer er spejlbilleder - som en venstre hånd og en højre hånd - af et molekyle. At være i stand til at vælge hvilken af de to enantiomerer af molekylet de producerer, og derfor hvilken type 'håndhed' den har, er nøglen.
For mens en enantiomer af molekylet kan producere den ønskede terapeutiske effekt, den anden enantiomer kan enten have nogen effekt overhovedet, eller kan medføre uønskede bivirkninger. Derudover chiraliteten, eller 'håndhed', " af enantiomeren kan være afgørende for at sikre præcision i, hvordan den interagerer i et biologisk system.
"Naturen selv udviser chiralitet på flere måder. Proteiner er dannet af aminosyrebyggesten, der eksisterer naturligt som én enantiomer, dvs de er enhånds. Plus DNA besidder spiralformet chiralitet, " Robert forklarer. "Så som syntetiske kemikere, det er virkelig vigtigt, at vi er i stand til at lave små molekyler som enkelte enantiomerer. Når vi skal sætte et lille molekyle ind i et biologisk system, hvor vi håber, det vil have, for eksempel, en terapeutisk effekt, den 'venstre' enantiomer kan passe helt anderledes ind sammenlignet med den 'højre' enantiomer."
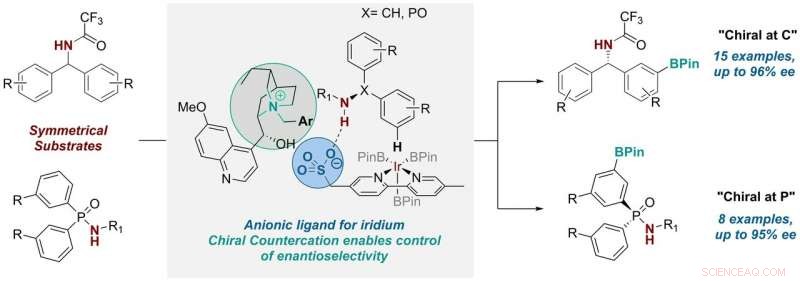
Tre år siden, gruppen udviklede en ligand til overgangsmetalkatalysatorer, der kontrollerede den positionelle selektivitet i en CH-aktiveringsreaktion - en nyttig reaktion, der er meget udbredt i den farmaceutiske industri og normalt opnås ved hjælp af overgangsmetalkatalyse. De gjorde dette ved at tage et almindeligt bipyridinligandstillads og vedhæfte en anionisk sulfonatgruppe til det.
Efter at have knyttet denne anioniske (eller negativt ladede) gruppe til stilladset, de havde så brug for en positivt ladet komponent for at balancere den. I deres tidligere arbejde, forskerne brugte en almindelig kation (tetrabutylammonium) til denne rolle, hvilket oprindeligt kun skulle give saltets opløselighed i organiske opløsningsmidler. Men de indså, at "vi havde en mulighed for at bringe en chiral kation ind her, som potentielt kunne være involveret i reaktionens overgangstilstand og øve en vis indflydelse på den, " forklarer Robert. Så de satte sig for at undersøge, om det var muligt.
Ph.D. studerende Georgi Genov arbejdede først på ideen, hvilket i sidste ende involverede to yderligere ph.d. studerende, James Douthwaite og David Gibson, og en postdoc forsker, Antti Lahdenperä. De erstattede den achirale tetrabutylammoniumkation med en chiral kation afledt af det naturligt forekommende anti-malaria kinin. Og ved at gøre det, de fandt ud af, at de var i stand til at kontrollere ikke kun den positionelle selektivitet, men også enantioselektiviteten i reaktionen, som erstatter a CH-bindingen på en aromatisk ring med en alsidig C-B-binding.
Georgi siger:"Optimeringsprocessen for denne transformation var ret involveret. efter at have opdaget de rigtige kation- og reaktionsbetingelser, vi observerede, at systemet var bemærkelsesværdigt generelt, hvilket tillod os at bruge to meget forskellige substratklasser - en hvor det nye stereocenter er ved et carbonatom, og en, hvor den er ved fosfor. Sidstnævnte er meget spændende, da syntese af chirale og fosforforbindelser er mere udfordrende."
Hidtil, der har været meget veletablerede måder at udføre enantioselektive reaktioner med overgangsmetaller på - men de er normalt afhængige af at indføre en form for chiralitet direkte i ligandstilladset, der er fastgjort til metallet, og "der kan være ulemper ved denne tilgang, som betyder, at den ikke virker i nogle situationer, " siger Robert.
"Vi ved, at disse chirale kationer, af den type vi bruger, er virkelig privilegerede, fordi de er blevet brugt i andre former for asymmetrisk katalyse. Men de er næsten ikke blevet brugt med overgangsmetaller. Så hvis vi potentielt kunne forene disse privilegerede chirale kationer med reaktive overgangsmetaller, så har vi måske fået en ny og helt anderledes måde at tænke på at lave asymmetrisk overgangsmetalkatalyse på."
Han tilføjer:"Vi er spændte på at se på at udrulle dette til andre virkelig nyttige overgangsmetalkatalyserede reaktioner, hvor der er udfordringer med at udføre dem enantioselektivt. Specifikt, vi vil gerne se, om vi kan aktivere enantioselektive reaktioner, som ikke har været mulige før, ved at bruge denne strategi."
 Varme artikler
Varme artikler
-
 Aflytning af enkelte molekyler med lys ved at afspille snakken igenKredit:CC0 Public Domain Forskere har været banebrydende for en ny teknik til at afsløre skjulte biokemiske veje, der involverer enkelte molekyler på nanoskala. Et team af forskere fra University
Aflytning af enkelte molekyler med lys ved at afspille snakken igenKredit:CC0 Public Domain Forskere har været banebrydende for en ny teknik til at afsløre skjulte biokemiske veje, der involverer enkelte molekyler på nanoskala. Et team af forskere fra University -
 Bløde robotaktuatorer heler sig selvSerie af proteinbaserede kunstige muskler, med ydeevne, der overstiger den biologiske muskels. Andre bløde robotdele kan omfatte bløde gribere og bløde aktuatorer. Kredit:Demirel Lab, Penn State G
Bløde robotaktuatorer heler sig selvSerie af proteinbaserede kunstige muskler, med ydeevne, der overstiger den biologiske muskels. Andre bløde robotdele kan omfatte bløde gribere og bløde aktuatorer. Kredit:Demirel Lab, Penn State G -
 Forbindelse kan omdanne energilagring til store netEllen Matson, venstre, adjunkt i kemi, og ph.d.-studerende Lauren VanGelder på arbejde i Matsons laboratorium. VanGelder er hovedforfatter på et papir, der beskriver modifikationer af et redoxflow-bat
Forbindelse kan omdanne energilagring til store netEllen Matson, venstre, adjunkt i kemi, og ph.d.-studerende Lauren VanGelder på arbejde i Matsons laboratorium. VanGelder er hovedforfatter på et papir, der beskriver modifikationer af et redoxflow-bat -
 Molekyle egenskaber ændres gennem lysTobias Thomanek, Enrique Mendez Vega og Wolfram Sander (fra venstre). Ikke afbildet, men væsentligt involveret i undersøgelsen:Iris Trosien. Kredit:RUB, Marquard Inden for computerteknik, magnetis
Molekyle egenskaber ændres gennem lysTobias Thomanek, Enrique Mendez Vega og Wolfram Sander (fra venstre). Ikke afbildet, men væsentligt involveret i undersøgelsen:Iris Trosien. Kredit:RUB, Marquard Inden for computerteknik, magnetis
- Malaysia vil presse EU om planlagt palmeolieforbud i biobrændstoffer
- Iskolde måner, galaksehobe, og fjerne verdener udvalgte mål for Webb Telescope
- Elementer, der taber elektroner i en reaktion
- Forskere får transformationel AI til at virke umærkeligt
- De sydlige oceaner bidrager til at drive det globale kulstofkredsløb stærkere end forventet
- Stigende forsikringsomkostninger kan overbevise amerikanerne om, at risici for klimaændringer er re…


