Hvorfor er massen af atomerelektroner ikke inkluderet i antal?
* Masseforskel: Protoner og neutroner har omtrent den samme masse (ca. 1 atommasseenhed eller AMU). Elektroner er på den anden side meget lettere med en masse på kun ca. 1/1836 amu.
* Relativ overflod: Atomer har et lignende antal protoner og neutroner. Antallet af elektroner er lig med antallet af protoner. Dette betyder, at den samlede masse af elektroner er væsentligt mindre end den samlede masse af protoner og neutroner.
Eksempel:
Overvej et carbon-12-atom:
* Protoner: 6 (6 x 1 amu =6 amu)
* neutroner: 6 (6 x 1 amu =6 amu)
* Elektroner: 6 (6 x 1/1836 amu =0,0033 amu)
Den samlede masse af protoner og neutroner er 12 amu, mens elektronerne kun bidrager med en lille brøkdel af den samlede masse.
Praktiske implikationer:
* atommasseenheder: Atommasseenheden (AMU) er defineret på baggrund af massen af carbon-12, hvor elektronens masse betragtes som ubetydelig.
* Beregninger: I de fleste kemiske beregninger er elektronens masse ubetydelig og kan ignoreres for enkelhed.
* nukleare reaktioner: I nukleare reaktioner, hvor massenergi-konverteringer er signifikante, overvejes elektronmassen.
Kortfattet: Massen af elektroner ignoreres ikke helt, men dens bidrag er så lille sammenlignet med kernen, at den ofte ignoreres til praktiske formål.
Sidste artikelHvad er gode og dårlige ting ved uran?
Næste artikelHvad er produkterne i Benguet?
 Varme artikler
Varme artikler
-
 Teams billede af revner i handlingen kunne forhindre tekniske fejlAvanceret billeddannelse giver spor til at forudsige brud i metaller. I dette studie, revner i en nikkellegering, der blev sprød af brint, blev fanget rødhændede, da de forplantede sig langs korngræns
Teams billede af revner i handlingen kunne forhindre tekniske fejlAvanceret billeddannelse giver spor til at forudsige brud i metaller. I dette studie, revner i en nikkellegering, der blev sprød af brint, blev fanget rødhændede, da de forplantede sig langs korngræns -
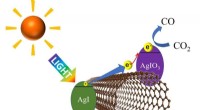 Brug af synligt lys til effektivt at nedbryde kuldioxidDen fotoeksciterede elektron fra sølviodid (AgI) bevæger sig langs kulnanorøret til sølviodat (AgIO 3 ) hvor kuldioxid (CO 2 ) reduceres til carbonmonoxid (CO). Kredit:Shinji Kawasaki og Yosuke Is
Brug af synligt lys til effektivt at nedbryde kuldioxidDen fotoeksciterede elektron fra sølviodid (AgI) bevæger sig langs kulnanorøret til sølviodat (AgIO 3 ) hvor kuldioxid (CO 2 ) reduceres til carbonmonoxid (CO). Kredit:Shinji Kawasaki og Yosuke Is -
 Skaller og grapefrugter inspirerer til først fremstillet ikke-skærbart materialeKredit:CC0 Public Domain Ingeniører har hentet deres inspiration fra skaller og grapefrugter til at skabe, hvad de siger er det første fremstillede ikke-skærbare materiale. Dette nye materiale, s
Skaller og grapefrugter inspirerer til først fremstillet ikke-skærbart materialeKredit:CC0 Public Domain Ingeniører har hentet deres inspiration fra skaller og grapefrugter til at skabe, hvad de siger er det første fremstillede ikke-skærbare materiale. Dette nye materiale, s -
 Nøglen til at sænke kuldioxidemissionerne er lavet af metalDe tilsyneladende rater for det ME-katalyserede malat (v0) under tilstanden NADPH, pyruvat, natriumbicarbonat og ME indeholdende aluminiumioner (røde). Kredit:Yutaka Amao, Osaka City University Ku
Nøglen til at sænke kuldioxidemissionerne er lavet af metalDe tilsyneladende rater for det ME-katalyserede malat (v0) under tilstanden NADPH, pyruvat, natriumbicarbonat og ME indeholdende aluminiumioner (røde). Kredit:Yutaka Amao, Osaka City University Ku
- Første gang nogensinde direkte observation af kirale strømme i quantum Hall atom-simulering
- Hvilke lande i Afrika er nord eller syd for den tropiske Stenbukken?
- Beskyttelse af probiotika fra maven
- 15 Moores Years:3D-chipstabling vil føre Moores Law forbi 2020
- I fotosyntesen Hvor forlader iltbladet blad?
- Er der liv på superjorder? Svaret kunne ligge i deres kerne


