Hvad er den komplette jordtilstandselektronkonfiguration for galliumatom?
1S² 2S² 2P⁶ 3S² 3P⁶ 4S² 3D¹⁰ 4P¹
Sådan forstår du det:
* 1S²: Det første energiniveau (n =1) har en underskal (er) med to elektroner.
* 2s² 2p⁶: Det andet energiniveau (n =2) har to underskaller, S og P, med i alt otte elektroner.
* 3s² 3p⁶: Det tredje energiniveau (n =3) har to underskaller, S og P, med i alt otte elektroner.
* 4S²: Det fjerde energiniveau (n =4) starter med S -underskalet, der indeholder to elektroner.
* 3d¹⁰: Efter påfyldningsordren fyldes 3D -underskalet (som kan holde op til 10 elektroner) næste med ti elektroner.
* 4p¹: Endelig modtager 4P -underskallen sin første elektron, der afslutter konfigurationen til gallium.
Vigtig note: Fyldningsordren for elektroner følger Aufbau -princippet og Hunds regel, som er nyttige til at bestemme elektronkonfigurationen af elementer.
Sidste artikelHvad er elektronkonfigurationen?
Næste artikelNavngiv noget ikke -metal i fast tilstand?
 Varme artikler
Varme artikler
-
 Video:Skal du tisse på et vandmandsstik?Kredit:The American Chemical Society Jo da, maneter ser temmelig rolige ud, men vi kender alle ondskaberne, der kommer fra et tilløb med de fangarme. Du har sikkert hørt rygtet om, at tisse på et
Video:Skal du tisse på et vandmandsstik?Kredit:The American Chemical Society Jo da, maneter ser temmelig rolige ud, men vi kender alle ondskaberne, der kommer fra et tilløb med de fangarme. Du har sikkert hørt rygtet om, at tisse på et -
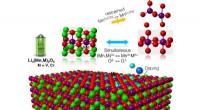 Forskere forudser materialer til at stabilisere et lithium-ion-batteri med rekordhøj kapacitetEn skematisk illustration af batteriets katodestruktur, hvor litium er rødt, ilt er grønt, mangan er lilla, krom er mørkeblå og vanadium er lyseblå. Kredit:Wolverton Research Group, Northwestern Unive
Forskere forudser materialer til at stabilisere et lithium-ion-batteri med rekordhøj kapacitetEn skematisk illustration af batteriets katodestruktur, hvor litium er rødt, ilt er grønt, mangan er lilla, krom er mørkeblå og vanadium er lyseblå. Kredit:Wolverton Research Group, Northwestern Unive -
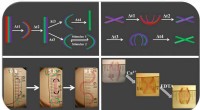 4-D bioingeniørmaterialer bøjning, kurve som naturligt væv4D hydrogel-baserede materialer kan gennemgå flere konformationelle formændringer som reaktion på miljømæssige signaler. Kredit:Aixiang Ding Vævsteknik har længe været afhængig af geometrisk stati
4-D bioingeniørmaterialer bøjning, kurve som naturligt væv4D hydrogel-baserede materialer kan gennemgå flere konformationelle formændringer som reaktion på miljømæssige signaler. Kredit:Aixiang Ding Vævsteknik har længe været afhængig af geometrisk stati -
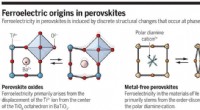 En måde at lave renere metalfrie perovskitter til en lav prisFerroelektricitet i perovskitter induceres af diskrete strukturelle ændringer, der sker ved faseovergange. Kredit:(c) C. Bickel/ Videnskab (2018). DOI:10.1126/science.aas9330 Et team af forskere
En måde at lave renere metalfrie perovskitter til en lav prisFerroelektricitet i perovskitter induceres af diskrete strukturelle ændringer, der sker ved faseovergange. Kredit:(c) C. Bickel/ Videnskab (2018). DOI:10.1126/science.aas9330 Et team af forskere
- Slovensk flagskib får uge til at løse pengekrise
- Kvinder bør inddrages i beslutninger om beskyttelse af menneskerettighederne i klimakrisen, mener f…
- Hvad forårsager farveændringen og nedbøren i vand?
- 10 lande med perfekte klimaer
- NASA opretter et proxy -kort for oversvømmelser over områder, der er ramt af den tropiske storm Ba…
- Er ansættelse af flere sorte betjente nøglen til at reducere politivold?


