Hvorfor har calcium ikke 10 elektron i sin 3. skal?
Her er en sammenbrud:
* atomnummer: Calcium har et atomnummer på 20, hvilket betyder, at det har 20 protoner og 20 elektroner.
* Elektronkonfiguration: Den elektroniske konfiguration af calcium er 1S² 2S² 2p⁶ 3S² 3P⁶ 4S² .
* skalfyldning:
* Den første skal (n =1) kan maksimalt indeholde 2 elektroner (1S²).
* Den anden skal (n =2) kan maksimalt indeholde 8 elektroner (2S² 2p⁶).
* Den tredje skal (n =3) kan maksimalt indeholde 18 elektroner, men den er ikke fuldt ud udfyldt calcium.
* Hvorfor ikke 10 elektroner i den 3. skal?
* Underskalet 4S (som er en del af den 4. skal) har lavere energi end 3D -underskalet . Dette skyldes afskærmningseffekten af indre elektroner, hvilket gør 4S -underskallen mere stabil.
* Derfor er 4S -underskalet først fyldt og holder 2 elektroner (4S²), før der går nogen elektroner ind i 3D -underskalet.
Kortfattet: Calcium har 8 elektroner i sin 3. skal (3S² 3P⁶), fordi 4S -underskalet først er fyldt, hvilket efterlader 3D -underskalet tomt.
 Varme artikler
Varme artikler
-
 Forskere gør fremskridt inden for kontrol af kamæleonlignende materiale til næste generations com…Kredit:Texas A&M University Forskere fra Texas A&M University rapporterer om betydelige fremskridt i deres forståelse og kontrol af et kamæleonlignende materiale, der kan være nøglen til næste gen
Forskere gør fremskridt inden for kontrol af kamæleonlignende materiale til næste generations com…Kredit:Texas A&M University Forskere fra Texas A&M University rapporterer om betydelige fremskridt i deres forståelse og kontrol af et kamæleonlignende materiale, der kan være nøglen til næste gen -
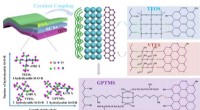 Silan regulerer termisk ledningsevne af kompositter på molekylært niveauFig. 1. Skematisk af PVA/fBN med forskellige SCA -koblinger. Kredit:CHENG Hua Et forskerhold fra Institute of Solid State Physics, Hefei Institutes of Physical Science har gennemført en undersøgel
Silan regulerer termisk ledningsevne af kompositter på molekylært niveauFig. 1. Skematisk af PVA/fBN med forskellige SCA -koblinger. Kredit:CHENG Hua Et forskerhold fra Institute of Solid State Physics, Hefei Institutes of Physical Science har gennemført en undersøgel -
 Fordelen ved 2D metal-organiske ramme-nanoark i sanseapplikationerGrafisk abstrakt. Kredit:LI Xixuan I de seneste år, fluorescerende metal-organiske rammer (MOFer) er blevet demonstreret som en lovende strategi til konstruktion af sensorer. Imidlertid, de fleste
Fordelen ved 2D metal-organiske ramme-nanoark i sanseapplikationerGrafisk abstrakt. Kredit:LI Xixuan I de seneste år, fluorescerende metal-organiske rammer (MOFer) er blevet demonstreret som en lovende strategi til konstruktion af sensorer. Imidlertid, de fleste -
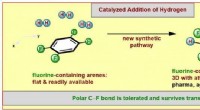 En ny metode til dannelse af fluorerede molekylære ringeillustration af den nye syntetiske metode. Kredit:WWU/Frank Glorius Farvestoffer, lægemidler, og funktionelle materialer er generelt baseret på innovative molekyler fremstillet af kemikere. Til de
En ny metode til dannelse af fluorerede molekylære ringeillustration af den nye syntetiske metode. Kredit:WWU/Frank Glorius Farvestoffer, lægemidler, og funktionelle materialer er generelt baseret på innovative molekyler fremstillet af kemikere. Til de


