Hvorfor har reaktionsblandingen ikke 50 procent reaktant og produkt i ligevægtsposition?
* ligevægt favoriserer siden med lavere fri energi: Ligevægt nås, når de fremadrettede og omvendte reaktionshastigheder er ens. Dette betyder ikke, at koncentrationerne er ens. Ligevægt favoriserer siden af reaktionen med den nedre Gibbs frie energi (ΔG). Dette er påvirket af faktorer som:
* entalpiændring (ΔH): Exotermiske reaktioner (frigivelse af varme) favoriseres ved ligevægt.
* entropiændring (ΔS): Reaktioner, der øger lidelsen (højere entropi), favoriseres.
* ligevægtskonstant (K): Ligevægtskonstanten (K) kvantificerer de relative mængder reaktanter og produkter i ligevægt.
* k> 1: Produkterne foretrækkes i ligevægt.
* k <1: Reaktanterne foretrækkes i ligevægt.
* k =1: Reaktanterne og produkterne er til stede i omtrent lige store mængder.
* reaktionsstøkiometri: Den afbalancerede kemiske ligning dikterer molforholdene mellem reaktanter og produkter. For eksempel i en reaktion som:
`` `
A + b <=> 2c
`` `
Selv hvis ligevægtskonstanten er 1, har du ikke 50% A + B og 50% C. Du har en anden fordeling for at tilfredsstille forholdet 1:1:2 mol.
Eksempel:
Forestil dig en reaktion med en ligevægtskonstant (K) på 10. Dette betyder, at produkterne er stærkt foretrukne ved ligevægt. Ved ligevægt finder du sandsynligvis en meget højere procentdel af produkter end reaktanter.
Kortfattet:
Ligevægtspositionen bestemmes af den relative frie energi fra reaktanter og produkter, hvilket afspejles i ligevægtskonstanten. Dette fører ofte til ulige koncentrationer af reaktanter og produkter i ligevægt. Opdelingen af 50/50 er kun et specielt tilfælde, der kun forekommer i specifikke scenarier med en K -værdi tæt på 1.
 Varme artikler
Varme artikler
-
 Hvordan RNA blev dannet ved livets oprindelseDette er en computergrafik af et RNA-molekyle. Kredit:Richard Feldmann/Wikipedia En enkelt proces for, hvordan en gruppe af molekyler kaldet nukleotider blev lavet på den tidlige Jord, før livet b
Hvordan RNA blev dannet ved livets oprindelseDette er en computergrafik af et RNA-molekyle. Kredit:Richard Feldmann/Wikipedia En enkelt proces for, hvordan en gruppe af molekyler kaldet nukleotider blev lavet på den tidlige Jord, før livet b -
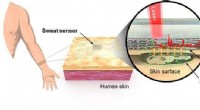 Hurtig, pålidelig lægemiddeldetektion på stedet ved hjælp af en bærbar sensorMedikamentdetektion i realtid ved hjælp af en optisk sensor fastgjort til den menneskelige hud. Kredit:Korea Institute of Materials Science (KIMS) Forskere i Sydkorea har med succes udviklet en bæ
Hurtig, pålidelig lægemiddeldetektion på stedet ved hjælp af en bærbar sensorMedikamentdetektion i realtid ved hjælp af en optisk sensor fastgjort til den menneskelige hud. Kredit:Korea Institute of Materials Science (KIMS) Forskere i Sydkorea har med succes udviklet en bæ -
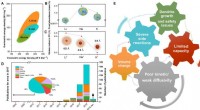 Forskere skitserer den nuværende tilstand af kalium-ion-batteriteknologiPIBs muligheder og udfordringer. (A) sammenligning af LIB, SIB, og PIB med hensyn til energitæthed. (B) overflod af lithium, natrium, og kaliummetal i jordskorpen (vægt%). (C) Stokes radius af Li+, Na
Forskere skitserer den nuværende tilstand af kalium-ion-batteriteknologiPIBs muligheder og udfordringer. (A) sammenligning af LIB, SIB, og PIB med hensyn til energitæthed. (B) overflod af lithium, natrium, og kaliummetal i jordskorpen (vægt%). (C) Stokes radius af Li+, Na -
 Alginsyre forbedrer kunstige knoglerTværsnitsmikrostrukturer i de indstillede CPC-prøver (a) uden og (b) med alginat (20 vægt%). Lidt porøsitet blev påvist i CPC-prøve uden alginat (a1). Tilsætning af alginat resulterede i dannelsen af
Alginsyre forbedrer kunstige knoglerTværsnitsmikrostrukturer i de indstillede CPC-prøver (a) uden og (b) med alginat (20 vægt%). Lidt porøsitet blev påvist i CPC-prøve uden alginat (a1). Tilsætning af alginat resulterede i dannelsen af
- Hvad støber og forme?
- Elektronorbitaler kan have nøglen til at forene konceptet om høj temperatur superledning
- Hvordan Turtles Sleep?
- Hvor mange ounces er der i 4,5 ounces?
- Undersøgelse syntetiserer, hvad klimaændringer betyder for nordvestlige naturbrande
- Hvorfor vises de fjerne bjerge blå, er det himmel, du ser mellem dem?


