Hvad får partiklerne af et stof til at være i en bestemt fase snarere end en anden?
Her er en sammenbrud:
* kinetisk energi: Dette er bevægelsesenergien. Jo højere temperatur er, jo mere kinetisk energi har partiklerne, og jo hurtigere bevæger de sig.
* attraktive kræfter: Dette er kræfter, der holder partiklerne sammen. De kan skyldes forskellige interaktioner, som hydrogenbinding, dipol-dipolstyrker eller London-spredningskræfter.
Lad os se mere detaljeret på hver fase:
solid:
* stærke attraktive kræfter: Partiklerne er tæt pakket og holdes sammen af stærke attraktive kræfter.
* lav kinetisk energi: Partiklerne vibrerer i faste positioner, men de har ikke nok energi til at overvinde de attraktive kræfter og bevæge sig frit.
* Fast form og volumen: Faststoffer har en bestemt form og volumen, fordi partiklerne er låst i en stiv struktur.
væske:
* moderate attraktive kræfter: Partiklerne er tættere sammen end i en gas, men de kan stadig bevæge sig rundt i hinanden.
* Moderat kinetisk energi: Partiklerne har nok energi til at overvinde nogle af de attraktive kræfter, så de kan bevæge sig forbi hinanden.
* fast volumen, men ikke form: Væsker har formen på deres beholder, men opretholder et fast volumen.
gas:
* svage attraktive kræfter: Partiklerne er langt fra hinanden og har meget svage attraktive kræfter mellem dem.
* høj kinetisk energi: Partiklerne bevæger sig meget hurtigt og tilfældigt og kolliderer med hinanden og væggene i deres beholder.
* Ingen fast form eller volumen: Gasser tager form og volumen på deres beholder, fordi partiklerne konstant bevæger sig og spreder sig.
Faseændringer:
Ændringer i temperatur og tryk påvirker balancen mellem kinetisk energi og attraktive kræfter, hvilket fører til faseændringer:
* Opvarmning: Øger kinetisk energi, hvilket gør det lettere for partikler at overvinde attraktive kræfter og overgang til en mindre ordnet tilstand (fast til væske, væske til gas).
* afkøling: Reducerer kinetisk energi, hvilket gør det mere sandsynligt for attraktive kræfter at dominere og partikler til overgang til en mere ordnet tilstand (gas til væske, væske til fast).
* stigende pres: Kræfter partikler tættere sammen, hvilket øger påvirkningen af attraktive kræfter og favoriserer en mere kondenseret tilstand (gas til væske, væske til fast).
* faldende pres: Tillader partikler at bevæge sig længere fra hinanden, svække de attraktive kræfter og favoriserer en mere udvidet tilstand (fast til væske, væske til gas).
Sammenfattende bestemmes fasen af et stof af den delikate balance mellem kræfterne, der holder dens partikler sammen og den energi, de besidder. Ændringer i temperatur og tryk kan skifte denne balance, hvilket fører til overgange mellem faste, flydende og gasformige tilstande.
Sidste artikelEr en æggeskal permeabel for salt?
Næste artikelEr alkalimetaller let tilgængelige i naturen?
 Varme artikler
Varme artikler
-
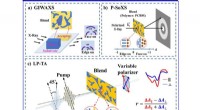 Undersøgelse af molekylær orientering ved polarisationsselektiv forbigående absorptionsspektrosko…Skematisk diagram over (a) GIWAXS, (b) P-SoXS og (c) LP-TA. Kredit:©Science China Press Den organiske solcelle (OSC) heterojunction -grænseflade er, hvor centrale fotofysiske processer som ladning
Undersøgelse af molekylær orientering ved polarisationsselektiv forbigående absorptionsspektrosko…Skematisk diagram over (a) GIWAXS, (b) P-SoXS og (c) LP-TA. Kredit:©Science China Press Den organiske solcelle (OSC) heterojunction -grænseflade er, hvor centrale fotofysiske processer som ladning -
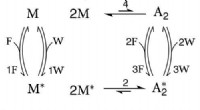 Ny termodynamisk ramme til cellerModel for energilagring og drevet syntese. Uden (hv. med) den orange stiplede overgang, det kemiske reaktionsnetværk modellerer energilagring (hhv. drevet syntese). Den højenergiske art A2A2 er i lav
Ny termodynamisk ramme til cellerModel for energilagring og drevet syntese. Uden (hv. med) den orange stiplede overgang, det kemiske reaktionsnetværk modellerer energilagring (hhv. drevet syntese). Den højenergiske art A2A2 er i lav -
 Ny trykteknik bruger celler og molekyler til at genskabe biologiske strukturerCeller spredes på ydersiden af et PA-baseret stillads. Kredit:Clara Hedegaard Forskere fra Queen Mary University of London har udviklet en printteknik, der bruger celler og molekyler, der normal
Ny trykteknik bruger celler og molekyler til at genskabe biologiske strukturerCeller spredes på ydersiden af et PA-baseret stillads. Kredit:Clara Hedegaard Forskere fra Queen Mary University of London har udviklet en printteknik, der bruger celler og molekyler, der normal -
 Små ændringer i overfladeaktive strukturer påvirker dets evne til at indkapsle olieagtige molekyl…Et overfladeaktivt stof (vist med rødt, gul og turkis) med en 14-carbon ‘hale’ danner et bølgende lag mellem vand (farveløst) og decan (grønt), som udvikler sig til knopper (midten) og derefter frie m
Små ændringer i overfladeaktive strukturer påvirker dets evne til at indkapsle olieagtige molekyl…Et overfladeaktivt stof (vist med rødt, gul og turkis) med en 14-carbon ‘hale’ danner et bølgende lag mellem vand (farveløst) og decan (grønt), som udvikler sig til knopper (midten) og derefter frie m
- Hvorfor nogle kvinder har reel grund til at frygte VM
- Hvad er funktionen af Tesla Coil?
- Storme Alpha og Beta opkaldt efter det græske alfabet, anden gang nogensinde
- Eksempler på archaebacteria med deres videnskabelige navn og klassificering <p> <p> Archaebacteria …
- Renault-præsident vil have CEO Bollore udskiftet:Fransk presse
- Fakta om ål til børn


