Definer kemisk kinectics og det komponenter?
Kemisk kinetik:afsløring af reaktionshastigheden
Kemisk kinetik er den gren af fysisk kemi, der beskæftiger sig med undersøgelsen af reaktionshastigheder og reaktionsmekanismer . Det undersøger, hvor hurtige kemiske reaktioner forekommer, og de faktorer, der påvirker deres hastighed. Det hjælper os med at forstå rejsen for reaktanter, der omdannes til produkter og de komplicerede trin, der er involveret.
komponenter i kemisk kinetik:
1. reaktionshastighed: Dette er hjørnestenen i kemisk kinetik. Det kvantificerer, hvor hurtigt en reaktion skrider frem. reaktionshastighed defineres som ændringen i koncentration af en reaktant eller produkt pr. Enhedstid. Det kan udtrykkes i forskellige enheder som mol/l/s, mol/cm³/min osv.
2. Bedømmelseslov: Denne matematiske ligning beskriver forholdet mellem reaktionshastigheden og koncentrationerne af reaktanter. Det hjælper med at forudsige, hvordan hastigheden ændres baseret på koncentrationen af hver reaktant. For en generel reaktion:
AA + BB -> CC + DD
Renteloven udtrykkes ofte som:
Hastighed =k [a]^m [b]^n
hvor:
* k er hastighedskonstant , en proportionalitetskonstant, der er specifik for reaktionen ved en given temperatur.
* [A] og [B] er koncentrationerne af reaktanter A og B.
* m og n er reaktionsordrer Med hensyn til henholdsvis A og B bestemmes eksperimentelt og ikke nødvendigvis lig med de støkiometriske koefficienter A og B.
3. reaktionsorden: Dette henviser til den effekt, som koncentrationen af en reaktant hæves i hastighedsloven . F.eks af reaktionen er summen af de enkelte ordrer (i dette tilfælde 3).
4. aktiveringsenergi (EA): Dette er den minimale energi, der kræves for reaktantmolekyler for at overvinde energibarrieren og danne produkter. Det bestemmer, hvor meget energi der er behov for for at starte reaktionen. Højere aktiveringsenergi oversættes til en langsommere reaktionshastighed.
5. Reaktionsmekanisme: Dette beskriver den trin-for-trin-sekvens af elementære reaktioner, der fører til den samlede reaktion. Hvert elementært trin involverer et eller to molekyler, der interagerer, og deres hastigheder kan være direkte relateret til koncentrationerne af reaktanter.
Faktorer, der påvirker reaktionshastigheden:
* Temperatur: Forøgelse af temperaturen øger generelt reaktionshastigheden, da molekyler har mere kinetisk energi til at overvinde aktiveringsenergien.
* Koncentration: Højere koncentrationer af reaktanter fører typisk til hurtigere reaktionshastigheder, da der er flere molekyler, der kolliderer.
* overfladeareal: For reaktioner, der involverer faste stoffer, øger øget overfladeareal af den faste reaktant hastigheden, da der er flere kontaktpunkter for reaktionen.
* katalysator: Katalysatorer er stoffer, der fremskynder reaktioner uden at blive konsumeret i processen. De giver en alternativ reaktionsvej med lavere aktiveringsenergi.
* Natur af reaktanter: De kemiske karakter af reaktanterne påvirker reaktionshastigheden signifikant, da forskellige molekyler har varierende reaktivitet.
Forståelse af kemisk kinetik:
At studere kemisk kinetik er afgørende af mange grunde:
* optimering af industrielle processer: Det hjælper med at designe og optimere industrielle processer ved at bestemme de optimale betingelser for det maksimale produktudbytte.
* Forståelse af biologiske processer: Det hjælper med at forstå de komplicerede mekanismer for biologiske processer som enzymkatalyse og cellulær respiration.
* Design af nye materialer og teknologier: Det giver os mulighed for at konstruere nye materialer og teknologier med specifikke egenskaber baseret på deres reaktionshastigheder og mekanismer.
* miljøvidenskab: Det hjælper os med at forstå satserne for miljøprocesser som forringelse af forurening og klimaændringer.
Kemisk kinetik er et komplekst og fascinerende felt, der giver en dyb forståelse af, hvordan kemiske reaktioner forekommer, og hvordan man kontrollerer deres hastighed. Dets applikationer er vidtrækkende og påvirker forskellige områder inden for videnskab og teknik.
 Varme artikler
Varme artikler
-
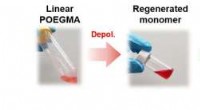 Nedbrydning af plast i dets bestanddeleMonomerer udvindes fra en polymer for at producere et nyt produkt, der igen kan nedbrydes til dets byggesten. Kredit:Wang HS et al., JASC, 2022 Et team af ETH-forskere ledet af Athina Anastasaki er
Nedbrydning af plast i dets bestanddeleMonomerer udvindes fra en polymer for at producere et nyt produkt, der igen kan nedbrydes til dets byggesten. Kredit:Wang HS et al., JASC, 2022 Et team af ETH-forskere ledet af Athina Anastasaki er -
 Sådan hjælper du miljøet:Gør madolie til vedvarende brændstofferZhiyao (Yao) Lu leder en USC Dornsife startup, der har udviklet en teknologi designet til at gøre vegetabilsk olie til vedvarende brændstoffer og bionedbrydeligt plast. Kredit:Rhonda Hillberry Dri
Sådan hjælper du miljøet:Gør madolie til vedvarende brændstofferZhiyao (Yao) Lu leder en USC Dornsife startup, der har udviklet en teknologi designet til at gøre vegetabilsk olie til vedvarende brændstoffer og bionedbrydeligt plast. Kredit:Rhonda Hillberry Dri -
 Edderkoppesilke kunne bruges som robotmuskelTvunget silke fra en Nephila pilipes edderkop. Kredit:Liu et al., Sci. Adv . 2019; 5:eaau9183 Edderkoppesilke, allerede kendt som et af de stærkeste materialer for sin vægt, viser sig at have en
Edderkoppesilke kunne bruges som robotmuskelTvunget silke fra en Nephila pilipes edderkop. Kredit:Liu et al., Sci. Adv . 2019; 5:eaau9183 Edderkoppesilke, allerede kendt som et af de stærkeste materialer for sin vægt, viser sig at have en -
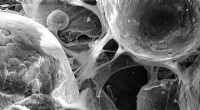 Forskere 3-D-printer biomedicinske dele med supersonisk hastighedDette billede viser celler, der klæber til en titanlegering skabt af koldspray 3D-print, som demonstrerer materialets biokompatibilitet. Kredit:Cornell University Glem lim, skruer, varme eller and
Forskere 3-D-printer biomedicinske dele med supersonisk hastighedDette billede viser celler, der klæber til en titanlegering skabt af koldspray 3D-print, som demonstrerer materialets biokompatibilitet. Kredit:Cornell University Glem lim, skruer, varme eller and
- Hvordan virker parfumeatomeren?
- At tale med neuroner:Nye nanostrukturerede neurale elektroder
- Metan lovende rute til lagring af vedvarende energi fra sol og vind
- Forskere finder ud af, hvordan celler bevæger sig, mens de undgår adhæsion
- Grøn infrastruktur til at håndtere mere intenst regnvand med klimaændringer
- Orkanen Jerry får sin temperatur taget af NASA-NOAA-satellitten


