Hvad er den kemiske formel for sammensat kobolt og svovlion?
* cobalt (CO): Kobolt kan danne flere ioner, men de mest almindelige er co²⁺ (cobalt (II)) og co³⁺ (cobalt (III)).
* svovl (r): Svovl danner typisk sulfidionen, S²⁻.
For at danne en neutral forbindelse, skal ionerne afbalancere. Her er mulighederne:
* kobolt (II) sulfid: Co²⁺ og s²⁻ har lige men modsatte afgifter, så formlen er simpelthen cos .
* cobalt (III) sulfid: Co³⁺ har en +3 opladning, mens S²⁻ har en -2 -afgift. For at afbalancere ladningerne har du brug for to cobalt (III) -ioner og tre sulfidioner. Formlen er co₂s₃ .
Derfor er den kemiske formel for forbindelsen mellem kobolt- og svovlioner enten COS (kobolt (II) sulfid) eller co₂s₃ (kobolt (III) sulfid), afhængigt af oxidationstilstanden for kobolt.
 Varme artikler
Varme artikler
-
 Undersøgelse opdaterer etnobotanik, fytokemi og farmakologisk undersøgelse af slægten Didymocarpu…Kredit:Consolata Nanjala Slægten Didymorcapus Wall. omfatter mere end 100 arter, der er vidt udbredt fra Himalaya til den malaysiske halvø. Arter i denne slægt er blevet brugt i traditionel medicin
Undersøgelse opdaterer etnobotanik, fytokemi og farmakologisk undersøgelse af slægten Didymocarpu…Kredit:Consolata Nanjala Slægten Didymorcapus Wall. omfatter mere end 100 arter, der er vidt udbredt fra Himalaya til den malaysiske halvø. Arter i denne slægt er blevet brugt i traditionel medicin -
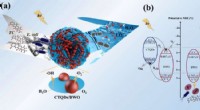 Forskere udvikler Z-skema katalysator for forurenende stoffer i vandSkematisk illustration af fotokatalytisk mekanisme. Kredit:YANG Pengqi I de seneste år, den hurtige industrialisering har forårsaget stadig mere alvorlig miljøforurening. Antibiotika og mikrobiolo
Forskere udvikler Z-skema katalysator for forurenende stoffer i vandSkematisk illustration af fotokatalytisk mekanisme. Kredit:YANG Pengqi I de seneste år, den hurtige industrialisering har forårsaget stadig mere alvorlig miljøforurening. Antibiotika og mikrobiolo -
 Kunstige celler-i-celler udløst af lys fungerer som mini-kemiske reaktorerCircles in a Circle af Kandinsky. Kredit:Philadelphia Museum of Art, Louise og Walter Arensbergs Samling, 1950-134-104 Kunstige celler, der frigiver materialer, når de udsættes for lys, er blevet
Kunstige celler-i-celler udløst af lys fungerer som mini-kemiske reaktorerCircles in a Circle af Kandinsky. Kredit:Philadelphia Museum of Art, Louise og Walter Arensbergs Samling, 1950-134-104 Kunstige celler, der frigiver materialer, når de udsættes for lys, er blevet -
 Konsortiet undersøger nye måder at reducere arsen i kobberkoncentraterRå kobber smeltning i en højovn. Kredit:Fraunhofer IWKS Som verdens største kobbereksportør støder Chile på et stigende antal svovlbaserede malmlag indeholdende giftig arsen i sine kobberminer. Kon
Konsortiet undersøger nye måder at reducere arsen i kobberkoncentraterRå kobber smeltning i en højovn. Kredit:Fraunhofer IWKS Som verdens største kobbereksportør støder Chile på et stigende antal svovlbaserede malmlag indeholdende giftig arsen i sine kobberminer. Kon
- Motoriseret protesearm, der kan mærke berøring, bevæge sig med dine tanker
- Forståelse af, hvordan zwitterioniske polymerer kan føre til sikrere lægemidler og sygdomsforebyg…
- Undersøgelse finder, at stigning i menupriser betyder et fald i restaurantvurderinger
- Ulemperne ved lineær programmering
- Udtalelse:Nobelprisvindende økonomi for klimaændringer er vildledende og farlig, og her er hvorfor
- Planteinspiration kan føre til fleksibel elektronik


