Hvorfor har forskellige atomer linjer i deres spektre?
1. Energiniveau og overgange:
* Elektroner i atomer kredser ikke bare kernen tilfældigt. De findes i specifikke energiniveauer, der ligner RING'er på en stige. Disse energiniveau er kvantiseret, hvilket betyder, at kun specifikke værdier er tilladt.
* Når en elektron absorberer energi (f.eks. Fra lys), kan det hoppe til et højere energiniveau. Dette kaldes excitation .
* Når en ophidset elektron falder tilbage til et lavere energiniveau, frigiver den overskydende energi som lys. Dette udsendte lys har en specifik frekvens (og derfor farve) bestemt af energiforskellen mellem de to niveauer.
2. Unikke energiniveau:
* Hvert element har et unikt arrangement af elektroner og protoner, der fører til et unikt sæt energiniveau. Dette er som om hvert element har en unik "stige" med forskellige rung -positioner.
* Derfor er energiforskellene mellem niveauer i hvert element unikke. Dette fører til forskellige atomer, der udsender lys ved specifikke bølgelængder (farver), hvilket skaber unikke spektrale linjemønstre.
3. Spektrale linjer:
* Når vi analyserer det lys, der udsendes af et ophidset atom, ser vi forskellige linjer ved specifikke bølgelængder, svarende til energiforskellene mellem dets energiniveau. Disse kaldes emissionslinjer .
* Omvendt, når lys passerer gennem en kold gas, kan atomer absorbere lys ved specifikke bølgelængder svarende til energiforskellene mellem deres niveauer. Dette skaber absorptionslinjer I spektret.
Kortfattet:
Linjerne i et atoms spektrum er et fingeraftryk af dets unikke energiniveaustruktur. Hvert element har sit eget specifikke mønster af linjer, hvilket giver os mulighed for at identificere de elementer, der er til stede i en prøve ved at analysere dets spektrum. Dette er grundlaget for spektroskopi, et kraftfuldt værktøj, der bruges til astronomi, kemi og andre felter.
 Varme artikler
Varme artikler
-
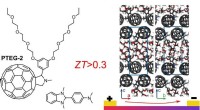 Gør varme til strøm med effektivt organisk termoelektrisk materialeDen kemiske struktur af fullerenderivatet, der anvendes i vores arbejde, forbedrer rækkefølgen af molekylerne som vist (til højre) i snapshots af den molekylære pakning. Ved at bruge et passende dop
Gør varme til strøm med effektivt organisk termoelektrisk materialeDen kemiske struktur af fullerenderivatet, der anvendes i vores arbejde, forbedrer rækkefølgen af molekylerne som vist (til højre) i snapshots af den molekylære pakning. Ved at bruge et passende dop -
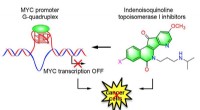 Nye kræftsygdomme kan bedre kontrollere tumorvækst i næsten alle kræftformerForskere fra Purdue University har opdaget potentielle kræftfremkaldende midler, der stabiliserer MYC-promotoren G-quadruplex og nedregulerer ekspressionen af MYC-onkogenet. Kredit:Purdue University
Nye kræftsygdomme kan bedre kontrollere tumorvækst i næsten alle kræftformerForskere fra Purdue University har opdaget potentielle kræftfremkaldende midler, der stabiliserer MYC-promotoren G-quadruplex og nedregulerer ekspressionen af MYC-onkogenet. Kredit:Purdue University -
 Vandmolekyler er guld til nanokatalyseKredit:CC0 Public Domain Nanokatalysatorer lavet af guld nanopartikler spredt på metaloxider er meget lovende for industri, selektiv oxidation af forbindelser, inklusive alkoholer, til værdifulde
Vandmolekyler er guld til nanokatalyseKredit:CC0 Public Domain Nanokatalysatorer lavet af guld nanopartikler spredt på metaloxider er meget lovende for industri, selektiv oxidation af forbindelser, inklusive alkoholer, til værdifulde -
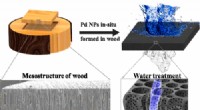 Træfilter fjerner giftigt farvestof fra vandetKredit:ACS Ingeniører ved University of Maryland har udviklet en ny anvendelse af træ:at filtrere vand. Liangbing Hu fra Energy Research Center og hans kolleger tilføjede nanopartikler til træ, br
Træfilter fjerner giftigt farvestof fra vandetKredit:ACS Ingeniører ved University of Maryland har udviklet en ny anvendelse af træ:at filtrere vand. Liangbing Hu fra Energy Research Center og hans kolleger tilføjede nanopartikler til træ, br
- Hvad er den direkte overførsel af varme fra et stof til en anden, der berører?
- Mikroreaktor til syntese med Grignard-reagenser
- Optrævling af genetikken ved diskussygdom hos hunde
- Hvorfor er det nødvendigt for bakterier at være i stand til at modstå udsving i temperaturen i de…
- Fosfor:Essentielt for livet - Er vi ved at løbe tør?
- Når varme ophører med at være et mysterium, spintronics bliver mere ægte


