Hvorfor finder ionisering sted i gasformige atomer?
1. Energiniveau og elektronkonfiguration:
* Atomer har specifikke energiniveauer, hvor elektroner bor.
* De yderste elektroner har den mindst bindende energi (de er mere løst holdt) og er mere modtagelige for ionisering.
2. Ioniseringsprocessen:
* Når et atom absorberer nok energi, kan det fremme en elektron til et højere energiniveau eller endda Fjern det fuldstændigt fra atomet.
* Denne energi kan leveres i forskellige former:
* varme: Kollisioner mellem gasmolekyler kan overføre nok kinetisk energi til at forårsage ionisering.
* lys: Fotoner med tilstrækkelig energi kan begejstre eller fjerne elektroner (fotoionisering).
* Elektrisk udladning: Elektroner, der er accelereret af et elektrisk felt, kan kollidere med gasatomer og forårsage ionisering.
3. Resultat af ionisering:
* Fjernelse af en elektron skaber en positivt ladet ion .
* Den fjernede elektron bliver en fri elektron .
Hvorfor gasformige atomer?
* Afstand mellem atomer: I gasser er atomer langt fra hinanden. Dette giver mulighed for lettere absorption af energi for at overvinde de elektrostatiske kræfter, der holder elektroner til kernen.
* fri bevægelighed: Den frie bevægelse af gaspartikler giver mulighed for kollisioner og energioverførsel, hvilket bidrager til ionisering.
* Ingen stærk binding: I modsætning til faste stoffer eller væsker har gasser svage interatomiske kræfter, så ionisering påvirker primært individuelle atomer snarere end hele strukturer.
Kortfattet: Ionisering i gasformige atomer er en proces, hvor ekstern energi absorberes, hvilket overvinder den elektrostatiske tiltrækning mellem kernen og elektronerne, hvilket resulterer i dannelse af ioner og frie elektroner.
Sidste artikelHvad er en løsning med pH større end 7?
Næste artikelHvad indeholder ikke altid de samme procentdel af forskellige stoffer?
 Varme artikler
Varme artikler
-
 Kraftværker drevet af lysKredit:CC0 Public Domain Grønne planter, alger og nogle bakterier bruger sollys til at omdanne energi. Pigmenterne i klorofyl absorberer elektromagnetisk stråling, som fremkalder kemiske reaktione
Kraftværker drevet af lysKredit:CC0 Public Domain Grønne planter, alger og nogle bakterier bruger sollys til at omdanne energi. Pigmenterne i klorofyl absorberer elektromagnetisk stråling, som fremkalder kemiske reaktione -
 Ny teknologi hjælper med at reducere salt, beholde smagForskerne brugte WSUs e-tunge til at måle virkningen af at reducere salt og intensiteten af andre ingredienser med deres nye MATS-behandlingsteknologi. Kredit:WSU At spise for meget salt kan h
Ny teknologi hjælper med at reducere salt, beholde smagForskerne brugte WSUs e-tunge til at måle virkningen af at reducere salt og intensiteten af andre ingredienser med deres nye MATS-behandlingsteknologi. Kredit:WSU At spise for meget salt kan h -
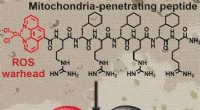 Et metallopeptid målretter og forstyrrer mitokondrielfunktionen i brystkræftstamcellerKredit:Wiley At dræbe maligne mitokondrier er en af de mest lovende fremgangsmåder i udviklingen af nye lægemidler mod kræft. Forskere fra Storbritannien har nu syntetiseret et kobberholdigt p
Et metallopeptid målretter og forstyrrer mitokondrielfunktionen i brystkræftstamcellerKredit:Wiley At dræbe maligne mitokondrier er en af de mest lovende fremgangsmåder i udviklingen af nye lægemidler mod kræft. Forskere fra Storbritannien har nu syntetiseret et kobberholdigt p -
 Blyhalogenidperovskitter er ikke ferroelektriskeScanningsretningsafhængighed af DPFM-signalerne. (a) Skema for DPFM-måling af en ferroelektrisk prøve (øverst venstre panel), med en antiparallel domænekonfiguration, hvor Pdw står for polarisation do
Blyhalogenidperovskitter er ikke ferroelektriskeScanningsretningsafhængighed af DPFM-signalerne. (a) Skema for DPFM-måling af en ferroelektrisk prøve (øverst venstre panel), med en antiparallel domænekonfiguration, hvor Pdw står for polarisation do
- Sådan fungerer lufthavnssikkerhed
- Opdagelse af solceller åbner et nyt vindue til at drive morgendagens byer
- Klimaændringer påvirker, hvornår og hvordan violer formerer sig
- Forskere opdager to tidlige stadier af carbon nanorørvækst
- Mod en lysdrevet molekylær assembler
- Hvis du spillede Pokemon som barn, kan der være en hel region i din hjerne, der er dedikeret til at…


