Hvor mange samlede ioner er til stede i 347 g CACL2?
1. Beregn molen af cacl₂:
* Molær masse af cacl₂: 40,08 g/mol (Ca) + 2 * 35,45 g/mol (Cl) =110,98 g/mol
* mol af cacl₂: (347 g) / (110,98 g / mol) =3,13 mol
2. Beregn molen af ioner:
* Hver cacl₂molekyle adskiller sig i 3 ioner: 1 ca²⁺ ion og 2 cl⁻ioner.
* Total mol ioner: 3.13 mol cacl₂ * 3 ioner/mol =9,39 mol ioner
3. Beregn antallet af ioner:
* avogadros nummer: 6,022 x 10²³ ioner/mol
* Samlet antal ioner: 9,39 mol ioner * 6,022 x 10²³ ioner/mol = 5,66 x 10²⁴ ioner
Derfor er der ca. 5,66 x 10²⁴ioner til stede i 347 g cacl₂.
 Varme artikler
Varme artikler
-
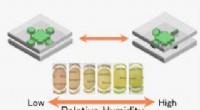 Funktionsfilm lavet af miljøvenlige lermineraler og farvestofferGennemsigtig hybridfilm sammensat af miljøvenlige lermineraler og farvestoffer, der ændrer farve med fugtighed via en ny mekanisme. Kredit:Shinsuke Takagi Forskere fra Tokyo Metropolitan Universit
Funktionsfilm lavet af miljøvenlige lermineraler og farvestofferGennemsigtig hybridfilm sammensat af miljøvenlige lermineraler og farvestoffer, der ændrer farve med fugtighed via en ny mekanisme. Kredit:Shinsuke Takagi Forskere fra Tokyo Metropolitan Universit -
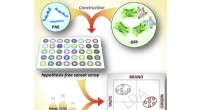 Forskere bruger en syntetisk tunge til at sortere whisky fraDette visuelle abstrakt viser et sensorsystem med tre elementer, der kan skelne alder, blandingsstatus, oprindelsesland, og smagselementer i whisky. Kredit:Jinsong Han et al./ Chem 2017 Whisky k
Forskere bruger en syntetisk tunge til at sortere whisky fraDette visuelle abstrakt viser et sensorsystem med tre elementer, der kan skelne alder, blandingsstatus, oprindelsesland, og smagselementer i whisky. Kredit:Jinsong Han et al./ Chem 2017 Whisky k -
 Forskning afdækker potentiel bæredygtig raffineringsmetode for ligninKredit:CC0 Public Domain Lignin, bruges som en vedvarende ressource til at producere produkter af høj værdi, har givet både produktionsmæssige og økonomiske udfordringer for bioraffinaderidriften.
Forskning afdækker potentiel bæredygtig raffineringsmetode for ligninKredit:CC0 Public Domain Lignin, bruges som en vedvarende ressource til at producere produkter af høj værdi, har givet både produktionsmæssige og økonomiske udfordringer for bioraffinaderidriften. -
 Monsanto mister appel i franske landmænds forgiftningssag (opdatering)Den franske landmand Paul Francois, venstre, og hans advokat Francois Lafforgue på et pressemøde i Lyon, sydøst Frankrig, efter at en appeldomstol stadfæstede hans retssag mod Monsanto over dens Lasso
Monsanto mister appel i franske landmænds forgiftningssag (opdatering)Den franske landmand Paul Francois, venstre, og hans advokat Francois Lafforgue på et pressemøde i Lyon, sydøst Frankrig, efter at en appeldomstol stadfæstede hans retssag mod Monsanto over dens Lasso


