Hvorfor placeres germanium i gruppe 14 og periode 4 i den periodiske tabel?
gruppe 14:
* Elektronisk konfiguration: Germanium har en elektronisk konfiguration af [AR] 3D 10 4S 2 4p 2 . Det har fire valenselektroner I sin yderste skal (4S 2 4p 2 ).
* Valenselektroner: Antallet af valenselektroner bestemmer gruppenummeret. Gruppe 14 elementer har alle fire valenselektroner, hvilket giver dem lignende kemisk opførsel. De har en tendens til at danne fire bindinger, enten kovalente eller ioniske.
* Lignende egenskaber: Elementer i gruppe 14 deler lignende egenskaber som:
* Dannelse af tetrahalider (som GECL 4 )
* Evne til at danne kovalente obligationer med andre ikke -metaller
* Dannelse af oxider med forskellige oxidationstilstande
periode 4:
* hovedkantenummer: Germaniums højeste besatte energiniveau er det fjerde skal (n =4), indikeret med "4" i dens elektroniske konfiguration.
* Antal elektronskaller: Periode 4 -elementer har alle fire elektronskaller, hvilket resulterer i lignende atomradier og ioniseringsenergier.
* atomradius: Når du bevæger dig over en periode, falder atomradius generelt på grund af øget atomafgift. Germanium passer ind i denne tendens og har en mindre atomradius sammenlignet med elementer i periode 3.
Kortfattet:
* gruppe 14: Germaniums fire valenselektroner placerer den i gruppe 14, kendt for sine elementer, der danner fire obligationer.
* periode 4: Germaniums fjerde elektronskal, angivet med dens elektroniske konfiguration, placerer den i periode 4.
Dets position i den periodiske tabel afspejler dens kemiske egenskaber og hvordan den opfører sig i reaktioner.
Sidste artikelHvad er den mest kondenserede stofstilstand?
Næste artikelHvordan syntetiseres dimedone?
 Varme artikler
Varme artikler
-
 Karakteriserede lægemidler viser uventede virkningerAnvendelse af den morfologiske og proteome profilering, en gruppe af allerede karakteriserede stoffer blev identificeret, som modulerer kolesterol-homeostasen. Kredit:MPI for molekylær fysiologi D
Karakteriserede lægemidler viser uventede virkningerAnvendelse af den morfologiske og proteome profilering, en gruppe af allerede karakteriserede stoffer blev identificeret, som modulerer kolesterol-homeostasen. Kredit:MPI for molekylær fysiologi D -
 Forskere rapporterer om en ny tilstand af stof beskrevet som flydende glasPlaceringen og orienteringen af ellipsoide partikler i klynger af et flydende glas. Kredit:Forskningsgrupper af professor Andreas Zumbusch og professor Matthias Fuchs Opdagelsen af flydende gl
Forskere rapporterer om en ny tilstand af stof beskrevet som flydende glasPlaceringen og orienteringen af ellipsoide partikler i klynger af et flydende glas. Kredit:Forskningsgrupper af professor Andreas Zumbusch og professor Matthias Fuchs Opdagelsen af flydende gl -
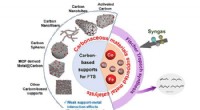 Kulstofbaserede katalysatorer anvendt til Fischer-Tropsch synteseKulstofholdige materialer understøtter metalkatalysatorer til FTS. Kredit:CHEN Yanping og WEI Jiatong Fischer-Tropsch-syntese (FTS) er en vigtig tilgang til omdannelse af kul, biomasse, og skiferg
Kulstofbaserede katalysatorer anvendt til Fischer-Tropsch synteseKulstofholdige materialer understøtter metalkatalysatorer til FTS. Kredit:CHEN Yanping og WEI Jiatong Fischer-Tropsch-syntese (FTS) er en vigtig tilgang til omdannelse af kul, biomasse, og skiferg -
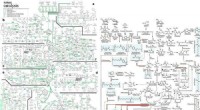 Et omfattende metabolisk kort til produktion af biobaserede kemikalierBiobaseret kemikalieproduktion ad biologiske og kemiske veje. Dette metaboliske kort beskriver repræsentative kemikalier, der kan fremstilles enten ved biologiske og/eller kemiske midler. Røde pile re
Et omfattende metabolisk kort til produktion af biobaserede kemikalierBiobaseret kemikalieproduktion ad biologiske og kemiske veje. Dette metaboliske kort beskriver repræsentative kemikalier, der kan fremstilles enten ved biologiske og/eller kemiske midler. Røde pile re
- Tre måder at polariteten af vandmolekyler påvirker adfærden af vand
- Hvad er den eneste stråleenergi, du kan se?
- Rumobjekt med kredsløb, der strækker sig ind i Oort-skyen, opdaget
- Oplåsning af kejserens Tarot-betydning
- Hvad dannes hovedsageligt af døde celler?
- Fra stenalderchips til mikrochips:Hvordan små værktøjer kan have gjort os til mennesker


