Forskellen mellem atomnummer og massetal?
atomnummer:
* Definition: Antallet af protoner i kernen i et atom.
* symbol: Z
* Nøgleegenskaber:
* Unik for hvert element.
* Bestemmer elementets identitet.
* Atomer med det samme element har altid det samme atomnummer.
* Eksempel: Carbon har et atomnummer på 6, hvilket betyder, at alle carbonatomer har 6 protoner i deres kerner.
Massenummer:
* Definition: Det samlede antal protoner og neutroner i kernen i et atom.
* symbol: EN
* Nøgleegenskaber:
* Kan variere for forskellige isotoper af det samme element.
* Repræsenterer den omtrentlige atommasse af et atom.
* Massenummeret er normalt et helt tal, men det kan variere lidt på grund af den bindende energi i kernen.
* Eksempel: Carbon-12 har et massetal på 12. Dette betyder, at det har 6 protoner og 6 neutroner (12 i alt). Carbon-14 har et massetal på 14, hvilket betyder, at det har 6 protoner og 8 neutroner (14 i alt).
Kortfattet:
* Atomnummeret definerer elementet, mens massetalet beskriver en specifik isotop af dette element.
* Antallet af protoner (atomnummer) bestemmer et elements kemiske egenskaber.
* Antallet af neutroner (som påvirker massetalet) kan påvirke et atoms stabilitet og radioaktivitet.
 Varme artikler
Varme artikler
-
 Et skridt nærmere produktion af miljøvenlig brintbrændstofKredit:CC0 Public Domain Griffith University-forskere sigter mod at låse op for en katalytisk proces, der vil forbedre nedbrydningen af vand, til brint og oxygen og bringe Australien et skridt t
Et skridt nærmere produktion af miljøvenlig brintbrændstofKredit:CC0 Public Domain Griffith University-forskere sigter mod at låse op for en katalytisk proces, der vil forbedre nedbrydningen af vand, til brint og oxygen og bringe Australien et skridt t -
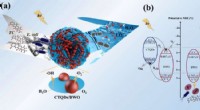 Forskere udvikler Z-skema katalysator for forurenende stoffer i vandSkematisk illustration af fotokatalytisk mekanisme. Kredit:YANG Pengqi I de seneste år, den hurtige industrialisering har forårsaget stadig mere alvorlig miljøforurening. Antibiotika og mikrobiolo
Forskere udvikler Z-skema katalysator for forurenende stoffer i vandSkematisk illustration af fotokatalytisk mekanisme. Kredit:YANG Pengqi I de seneste år, den hurtige industrialisering har forårsaget stadig mere alvorlig miljøforurening. Antibiotika og mikrobiolo -
 Et mere bæredygtigt materiale til forstærkning af betonkonstruktionerKredit:Alain Herzog / 2019 EPFL Den næste generation af ultra højtydende fiberarmeret beton (UHPFRC) er netop blevet skabt på EPFL. Det nye materiale vil blive brugt til at styrke og forlænge leve
Et mere bæredygtigt materiale til forstærkning af betonkonstruktionerKredit:Alain Herzog / 2019 EPFL Den næste generation af ultra højtydende fiberarmeret beton (UHPFRC) er netop blevet skabt på EPFL. Det nye materiale vil blive brugt til at styrke og forlænge leve -
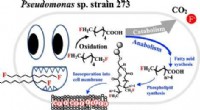 En naturligt forekommende jordbakterie kan give en løsning på evige kemikalierGrafisk abstrakt. Kredit:Environmental Science &Technology (2022). DOI:10.1021/acs.est.2c01454 University of Tennessee, Knoxville-fakultetets medlemmer Shawn Campagna, professor og associeret afdel
En naturligt forekommende jordbakterie kan give en løsning på evige kemikalierGrafisk abstrakt. Kredit:Environmental Science &Technology (2022). DOI:10.1021/acs.est.2c01454 University of Tennessee, Knoxville-fakultetets medlemmer Shawn Campagna, professor og associeret afdel
- Video:Lagrange-mission for at give solvarsling
- Forklar, hvorfor kan ikke lyd rejse gennem vakuum?
- Aktivisme ændrer museer til bedre, siger forsker
- Et unikt præcolumbiansk manuskript og mysteriet bag dets farver
- Hvordan klassificerer vi rock?
- Parker Solar Probe og det mærkelige tilfælde af den varme corona


