Afhænger massen af hvert element i en forbindelse af beløbets forbindelse?
* Kemisk formel: En forbindelses formel fortæller dig forholdet mellem atomer for hvert tilstedeværende element. For eksempel har vand (H₂O) altid to hydrogenatomer til hvert iltatom.
* atommasse: Hvert element har en specifik atommasse. Denne masse er konstant for dette element.
* proportioner: Massen af hvert element i en forbindelse bestemmes af forholdet mellem atomer i formlen og atommassen for hvert element.
Eksempel:
Lad os tage vand (H₂O) igen.
* atommasse brint (H): 1 Atommasseenhed (AMU)
* atommasse ilt (O): 16 amu
I et molekyle vand:
* Mass af brint: 2 h atomer * 1 amu/h atom =2 amu
* masse af ilt: 1 o atom * 16 amu/o atom =16 amu
Derfor masseforhold af brint til ilt i vand er 2:16 eller forenklet, 1:8.
mængde forbindelse:
* mere sammensat, mere masse: Hvis du har mere vand, har du mere brint- og iltatomer, og derfor en større masse af hvert element.
* mindre sammensat, mindre masse: Hvis du har mindre vand, har du færre brint- og iltatomer, og derfor en mindre masse af hvert element.
Konklusion:
Massen af hvert element i en forbindelse er direkte proportional med mængden af den tilstedeværende forbindelse. Forholdet mellem elementer i forbindelsen forbliver konstant, men den samlede masse af hvert element ændres med mængden af forbindelsen.
 Varme artikler
Varme artikler
-
 Udvikling af magnetiske kølematerialer, der muliggør effektiv brint-likvefaktionEn serie af Er(Ho)Co2-baserede forbindelser udviklet, som kan bruges i kombination til effektivt at afkøle brint fra 77 K til 20 K:dets flydende temperatur. Kredit:Sepehri Amin Hossein National Instit
Udvikling af magnetiske kølematerialer, der muliggør effektiv brint-likvefaktionEn serie af Er(Ho)Co2-baserede forbindelser udviklet, som kan bruges i kombination til effektivt at afkøle brint fra 77 K til 20 K:dets flydende temperatur. Kredit:Sepehri Amin Hossein National Instit -
 Turende strukturer i et menneskeskabt interfaceReaktionsdiffusionsprocessen drev dannelsen af den komplicerede uorganiske Turing -struktur. Kredit:ZHANG Xiaolong I 1952, Alan Turing, far til datalogi og kunstig intelligens, foreslået, at vis
Turende strukturer i et menneskeskabt interfaceReaktionsdiffusionsprocessen drev dannelsen af den komplicerede uorganiske Turing -struktur. Kredit:ZHANG Xiaolong I 1952, Alan Turing, far til datalogi og kunstig intelligens, foreslået, at vis -
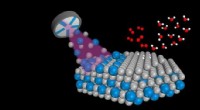 Nanolegeringer 10 gange så effektive som ren platin i brændselscellerNanolegeringer af platin (grå) og yttrium (blå) skabes ved brug af sputtering i et vakuumkammer. Dette gøres ved at rette plasma (lilla) mod et stykke platin med små vedhæftede stykker yttrium. De nan
Nanolegeringer 10 gange så effektive som ren platin i brændselscellerNanolegeringer af platin (grå) og yttrium (blå) skabes ved brug af sputtering i et vakuumkammer. Dette gøres ved at rette plasma (lilla) mod et stykke platin med små vedhæftede stykker yttrium. De nan -
 Spinifex lover stærkere kondomerKredit:CC0 Public Domain Spinifex græs kunne bruges til at skabe tyndere, stærkere latex til handsker og kondomer, samt mere holdbare tætninger og dæk, siger en australsk videnskabsmand. Advance
Spinifex lover stærkere kondomerKredit:CC0 Public Domain Spinifex græs kunne bruges til at skabe tyndere, stærkere latex til handsker og kondomer, samt mere holdbare tætninger og dæk, siger en australsk videnskabsmand. Advance
- Nyt AI-værktøj fanger, hvordan proteiner opfører sig i kontekst
- Slutningen på skovrydning i den brasilianske Amazonas?
- Hvor meget er 14 Celsius i Fahrenheit A?
- Ingen adskillelse nødvendig:Ikke-destruktiv metode til at måle bærerens levetid i SiC
- Tilpasning af ikke -linearitet med tidsdomænes metasurface til trådløs kommunikation
- En ny måde at levere lysfølsomme lægemidler til at bekæmpe problemet med antibiotikaresistens


